タグ: Astrazeneca
-
[Vaccine] 世界で開発された 新型コロナウイルス用ワクチンの有効性 – Pfizer, Moderna, Astrazeneca, Sinovac [2021/06/15]
Post Views: 1,092 はじめに 変異株は、イギリス株に加えインド株(デルタ株)が、感染力が良いた…
投稿者

-
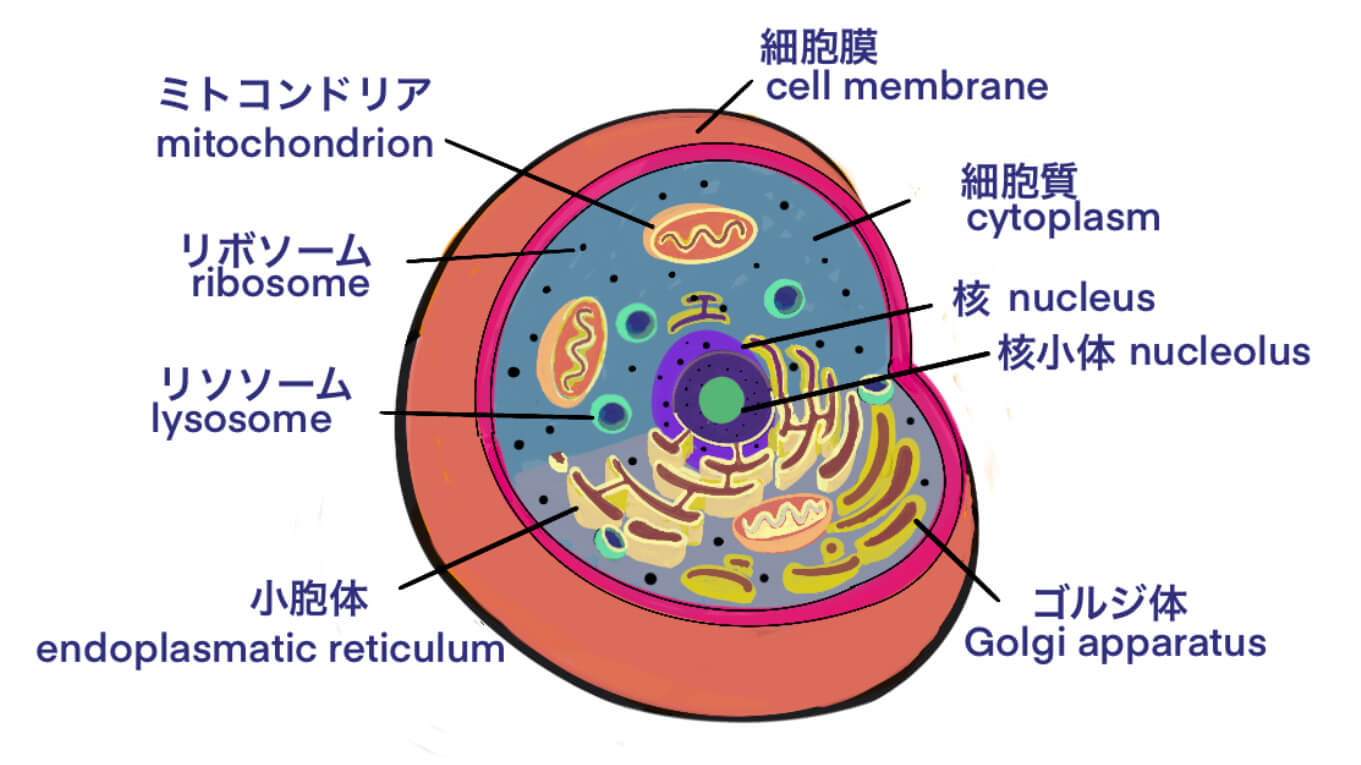
[Vc] アデノウイルス・ベクター・ワクチンとは – 新型コロナウイルスのワクチン開発で威力を発揮する – 必要な遺伝子のみを残す試行錯誤で、現在は第三世代 [2021/02/26]
アデノウイルス・ベクターにいて、複数の文献を網羅的にレビューした英語の文献を基に、アデノウイルス・ベクターは、…
投稿者

-
気になる企業 – AstraZeneca; アストラゼネカ [2021/01/28]
Post Views: 1,010 AstraZeneca AstraZeneca HOME PAGE サイト…
投稿者