Post Views: 3,332
はじめに
2023/11/15,内容(クラウドバックアップについて追加)を更新しました.編集履歴は,最後尾を参照してください.
ローカルネットワークに、DS918+とDS920+を立ち上げています。DS918+では、DS918+の外付けHDDにバックアップしています。DS920+のストレッジはSSDで構成しているので,HDDでストレッジを構成しているDS1621xs+(DS918+から移行)より少ないため、DS920+のバックアップ先は、DS1621xs+に設定して行っています。以下,DS918+はDS1621xs+に読み替えてください (2022/11/13).
最近までのバックアップ体制は、「Hyper Backup」と「SnapShot Replication」の2つの構成でしたが、「Synology Drive」を追加した3つの構成にしました。Synology Driveは、PC/iPadなどの端末のデータバックアップを目的に導入しています。
Hyper Backupは、NAS間や外付けUSB HDDにシステム設定やアプリケーションをバックアップすることができます。
SnapShot Replicationは、#snapshotフォルダーというシステム・フォルダを作り、そのフォルダー内に、指定した時間毎に差分のバックアップを作成し続けます。
Hyper BackupとSnapshot Replicationにより、復元能力が高まります。
忘れてはいけないのは、システムの設定などのバックアップです。これについても最後に示しています。
Driveは、Synology NAS同士でもバックアップが可能ですが、PCやiPadのデータをSynology NASにバックアップできます。そのモードは、(1)同期、(2)アップロードのみ、が可能です(追記、2022/01/08 by Mr. Harikiri)。
Hyper Backup/Snapshot Replication、そしてDrive
Synology NASのパッケージには、いくつかのバックアップ・ソリューションが無料で提供されています。その内、以下の2つのバックアップ・アプリケーションについて役割を意味付けし、それぞれを使い分ける運用を考えます。最後に、3つ目のパックアップアプリのDriveは、端末のデータ バックアップを目的に解説しました。
Hyper Backup
Snapshot Replication
Drive
Hyper Backupで十分か?
これまで、Hyper Backupのみで運用していました。どのようにパックアップを捉えたらいいのか、余りわからないまま使用していたわけです。
バックアップの運用では、長らくSnapshot Replicationも併用していまましたが、PCやiPadのデータ バックアップも統合的に行いたかったので、Driveの運用を追加しています。
Hyper Backup
Hyper Backupの運用は、毎日1回のバックアップを実行するにように、スケジューリングしています。
Hyper Backupの機能の概要は以下の通りです。
EXT4, Btrfswiki
対応するファイルシステムは、EXT4, Brtfsです
Snapshot Replicationと併用するには、ファイルシステムをBtrfsで構築する必要があります
バックアップファイルの「暗号化」
AmazonやGoogleなどの、ローカルでないパブリック・サーバー への保管もある程度は安心です
何らかの理由で、マシンを全てロストした場合でも、新しいDS918+を購入してデータを復旧できます
復元
バックアップファイルは、Hyper Backupでしか復元できない
バックアップの内容
「システム構成」のバックアップと復元
「アプリケーション構成」のバックアップと復元
「ブロックレベルの増分バックアップ」機能(初期バージョンの差)
「データ」のバックアップ
バックアップ先
「外付けUSB HDD」へのバックアップが可能。Btrfsである必要はない
「リモートSynology NAS」へのバックアップが可能。異なる敷地にあるNAS間が理想です
「ファイルサーバー」へのバックアップ
「クラウドサーバー」へのバックアップ
バックアップの「スケジューリング」
2つのバックアップソフトのインストールは、以下のリンクをご参照ください。
Synology NASをバックアップする方法
https://www.synology.com/ja-jp/knowledgebase/DSM/tutorial/Backup/How_to_back_up_your_Synology_NAS#t2.3
Snapshot Replication
Snapshot Replicationの複製先に必要な機能
ここで複製と言っているのは、2つの機能のことです。
Snapshotとは選択した共有フォルダのスナップショットを取得します 取得先は、共有フォルダ直下 の「#snapshot」フォルダです 設定した間隔でスナップショットを取得します
リビジョン 管理できます。Windowsのエクスブローカー から以前のバージョンを見たり,復元することができます
Replicationとは選択した共有フォルダの複製をスナップショットの形式ではなく、正に複製(replication)を取得します 複製先は、ローカルとリモート を設定できます。最近、DSMがバージョンアップしてから、ローカルが設定できなくなりました(2020/09/27, Mr. Harikiri)
リモートにも同様に「SnapShot Replication 」をインストールしておく必要があります
複製先には、以下のファイルシステム(Btrfs)の要件が必要です
リモートにReplication(複製)しても、#snapshotフォルダも複製されます。スイッチオーバーも可能ですsource
Btrfsボリューム
システムHDD (または最近ではSSD)の初期設定においてBtrfsを選択している必要があります
Snapshot Replication
必要なアプリです
複製先にリモートを設定する場合、リモートにも「Snapshot Replication」がインストーされている事が必要です
実質的には,Synology NAS間でしか複製(Replication)はしにくいか、または、できないのではないかと思われます.Synology製以外,且つ高機能なNASを持っていないので分かりません.
Snapshot Replication – DiskStation Manager – より
https://www.synology.com/ja-jp/knowledgebase/DSM/help/SnapshotReplication/data_protection_mgr
SynologyのDSMでNAS2台をLAN経由&インターネット経由で同期させてバックアップ&フェイルオーバー&リカバリしてみた
https://gigazine.net/news/20171005-synology-6th-review/
Drive
Synology Driveによるバックアップは、PC端末のデータを専用のクライアントソフトで修正されたら即時にそのままのフォルダ構造でバックアップしてくれます。また,当然,2つのNAS間でも可能です.
他方,HyperBackupの場合,1回限りのバックアップでは,そのバックアップ先ではそのままファイル/フォルダを閲覧したりアクセスが普通にできるようですが,定期的にバックアップする場合,バージョン管理されるため特別なフォーマットでバックアップされます.そのため,ファイル/フォルダは普通に閲覧することはできません.
そこで,NAS(1) – PC間または,NAS(1) – NAS(2)間で,そのままのフォルダ構造でバックアップしたい場合,即ち,ミラー情報としてバックアップしたい場合は,Synology Driveを使用します.
必要なアプリのインストー
Driveによるバックアップには、Synology NASにサーバー(Drive)をインストールし、データを保持している端末(PC/iPad/Synology NAS)にClientアプリをインストールして使用します。
サーバー用アプリ : Synology Drive (Synology Drive Adminコンソール)
Synology Driveでは、Adminコンソールで、すでに存在する共有フォルダに対してチームフォルダに設定したフォルダ内にサブフォルダの作成や、チームフォルダ/個人フォルダ内のファイル閲覧ができます。
Adminコンソールでは、クライアントと共有するためのチームフォルダの設定、クライアント・リストの確認、同期/アップロードなどのログの確認、及びドライブ容量などの情報の確認ができます。
NAS用のクライアント アプリ : Synology ShareSyc
ShareSycモードでは、シンクロモード(同期)やアップロードモード(サーバーにあるファイルを削除しない限り残る)させるモードの設定、及び、サーバー接続の設定が可能です。
サーバーにアップロードのみのモード
端末用のクライアント アプリ : Synology Drive Client
NAS用のクライアント アプリ (Synology Drive, webブラウザを使用)と同様の機能を持つPC用クライアントです。
パッケージセンターから「Drive」をインストールすると,以下の3つが機能追加されます.
Synology Drive: NASのDrive閲覧
Synology Drive ShareSync: NAS間の同期を設定
Synology Drive Admin Console: NAS上のフォルダーを指定
Synology Driveを追加したシステム構成全体としてのSynology DriveのモードやサーバーNASの構成は以下の通りです。
クライアント アプリではアップロードモードに設定
アップロードした先のサーバーNASでは、Hyper BackまたはSnapShot Replicationでバックアップを実施
運用(1) : PC/iPadは、それぞれのクライアントアプリをインストールして運用.
運用(2) : 以下は特種な運用方法ですが、事例として参考になると思うので、その運用概要を示しました。
A拠点には、光ネットワーク、サーバーNASを設置しています.
B拠点には、SoftBank Air (WiFi)、クライアントNASとPC/iPadを設置しています。日々、クライアントのデータが増加します.
B拠点のデータをA拠点にバックアップすることが目的です.
B拠点のNASのチームフォルダには、PC/iPadからネットドライブやDrive クライアントからデータがアップロードされます。
B拠点のNASのチームフォルダは、A拠点のDrive サーバー NASに自動的にアップロード(モード)されます。
A拠点のNASは、Hyper Back/SnapShot Replicationでバックアップされます。
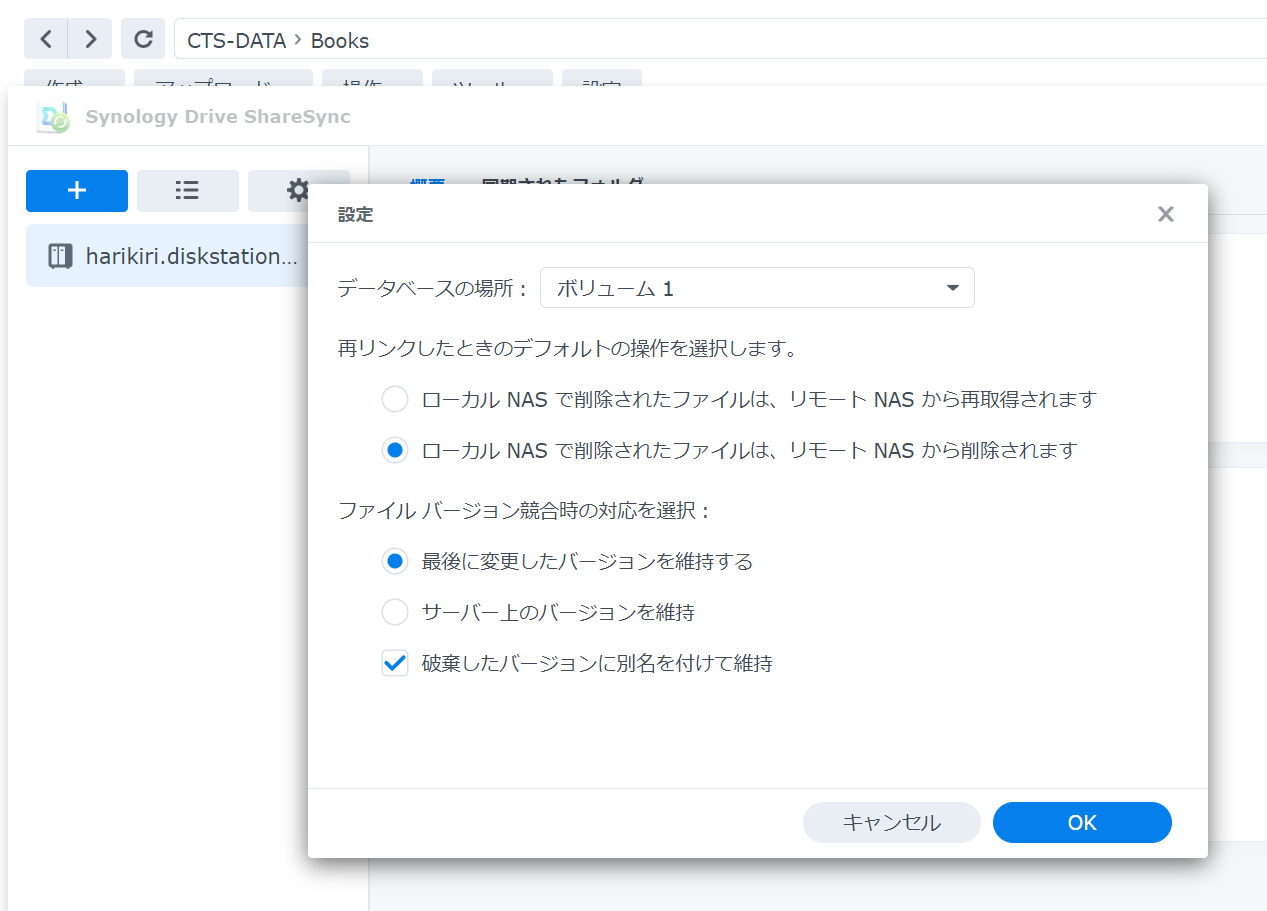
ミラーでバックアップ
クライアント側で,ミラーによるバックアップができるように設定します.下図は,NASのクライアントソフト(Dirve ShareSync)の場合の設定例です.
注意点ですが,項目「再リンクしたときのデフォルトの操作を選択します」の設定では,以下の事象が起こったので,その場合の対応策を示しました.因みに,「リモートNAS」は「サーバーNAS」のことです.
事象 : 不具合と対処方法
初期設定で,(1)「・・・リモートNASから再取得されます」としていました.
ミラーによるバックアップに変更するために,(2)「・・・リモートNASから削除されます」に変更し,OKで閉じて設定できたつもりでした.
一旦,リンクを解除して再接続したところ,(1)の設定が生きており,クライアントNASに削除したばすのテストファイルが生き返ってしまいました.
そこで,クライアントNASを再起動したところ,削除したテストファイルは生き返ることなく,リモートNASから削除されました.
この状態で,クライアントNASにある既存ファイルを削除してみたところ,リモートNASのミリーファイルも削除されることが確認できました.
すでにこのsynology nasに接続しています.
Synology Drive Clientで「同期タスク->作成」で新しくタスクを作ろうとした時に「すでにこのsynology nasに接続しています.」により作成できない場合があります.解決策の一つは,「バックアップタスク」を見てください.接続しようとしているDriveサーバーのタスクがあるはずです.これが既に接続されているという理由です.このタスクを削除すると「すでにこのsynology nasに接続しています.」は表示されなくなりタスクを作成できるようになります.
「同期タスク」と「バックアップタスク」の画面は機能面からすると本来は同期していなければならないはずですが,同期していないことで,「同期タスク->作成」ができないのか,だいぶ悩んでしまいましたが,これで無事解決です.
バックアップ体制の構築
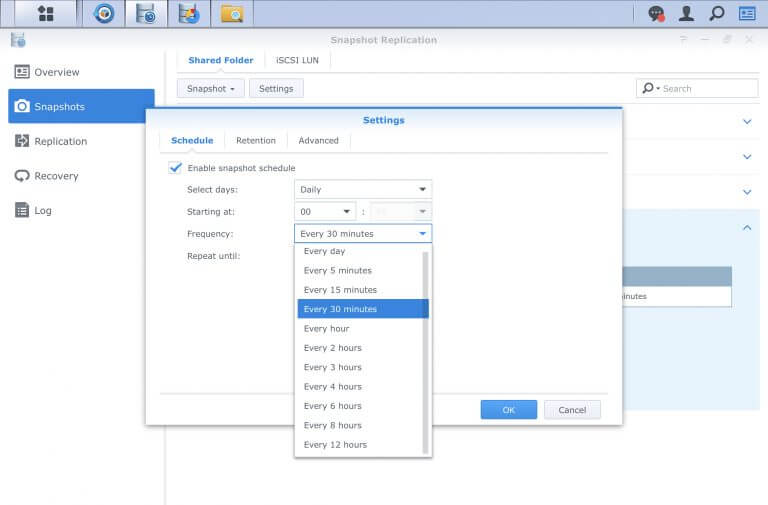
まず最初に設定しておきたい機能は、Snapshot Replicationの「snapshot」です。スケジュールングして、例えば10分や、30分毎に差分のバックアップを取るように設定します。最小5分の間隔も設定できます。
以下に、これら機能について、今一度まとめました。
Windowsからネットドライブとして使用している場合、前のバージョン(リビジョン)が保存されているので、ファイルのプロパティのバージョンから以前のものを復元できます
NAS モデルが Btrfsファイル システムをサポートしている場合、Snapshot Replication を使用してローカル コピーを作成できます(DS918+/DS920+は可能)
iSCSI LUN対応
Hyper Backupより処理速は高速
スナップショットのスケジューリング(予約スナップショット)は、の3モードがある
Synology Snapshot Manager
Snapshot, Synologyサイト –
https://www.synology.com/ja-jp/knowledgebase/DSM/help/SnapshotReplication/snapshots
最初のスナップショットを取ると、フルバックアップ が取られます。その後、バックアップとの差分 が取得されます。いずれも、スナップショットです。
Snapshot Replicationのインストールと設定方法及びスナップショットの概念について、ATCさんの以下の記事が大変参考になります。
Synology NASでスナップショットを取得する | Snapshot Replication
https://www.atc.jp/synology_nas_snapshot_replication/
バックアップの充実化
Synology NASに保管しているデータおよびNote StationやDBなど一部サーバーのバックアップは、Hyper Backupで必要十分です。
Snapshot Replicationを使えば、システム構成というより、データの復元に特に向いています。
この2つのバックアップを使うことで、よりきめ細かなバックアップにより、ほとんどの異常事態においても完全な復元および短時間で最新の復元が実現できます。
対応するNAS
Synology製品で、SnapShot Replicationが使用できる、Synology NASシリーズは、Synology site を参照してください。
Hyper BackupとSnapshot Replicationの比較
Hyper Backup
Hyper Backupの処理時間は、Snapshot Replicationの処理時間より多くかかるが、以下のリストおよび表1に示したように、5種類のストレッジにバックアップできます。暗号化も可能。
ローカル
外部USB
別のSynology NAS
ファイルサーバー
パブリッククラウド
Snapshot Replication
一方、Snapshot Replicationは、基本的に指定した共有フォルダのスナップショットを取得します。これがsnapshot機能です。そのスナップショットをバックアップするのが、replication機能です。
ランサムウェア対策には、Snapshot Replicationが良く使われているようです。
その対応策は、別途、replicationしていたデータを使いデータを再構築します。
表1. バックアップ・アプリの比較(Synology Siteより)
バックアップ先 Hyper Backup Snapshot Replication USB Copy Cloud Sync ローカル共有フォルダ あり あり なし なし 外部デバイス (USB) あり なし あり なし 別の Synology NAS あり あり なし なし ファイル サーバー あり なし なし WebDAV と OpenStack データ同期専用 パブリック クラウド あり なし なし あり
バックアップ戦略
バックアップは、(1)データが破損などによりカレントのデータ自体が無くなる場合、(2)サーバーが損傷する場合、(3)サーバーが置かれている場所が崩壊するなど、データ自体が無くなる要因は、最悪の場合も予想できます。
(1)データのみが無くなった場合は、ローカルのバックアップから復元すれば済む
(2)サーバーが損傷した場合、同じサーバーをあらためて購入するなどして用意し、別にバックアップしていたSynology NASやファイルサーバーから復元すればよい
(3)サーバーが置かれていた場所の崩壊の場合、パブリッククラウドのバックアップや別サイトのSynology NASのバックアップから復元できる。
個人の場合、自宅内にある別Synology NASか、Windowsのファイルサーバーにバックアップするものと想定されます。それは、一般的な選択肢になります。
また、パブリッククラウド(iCloud, Amazon, Googleなどから提供されるサービス)をバックアップの保存先に選択することは、Hyper Backupが暗号化機能を有していることから、そのハードルはそれほど高くないと思われます。
実際の運用
別のSynology NASがない場合、すなわち2台もNASないのが一般的だと思われるので、それを前提にすると、以下の運用がベターです。
因みに、最近、DS918+の後継機であるDS920+をblog用に導入しました。現在は、この二台体制によりバックアップ体制が充実しています(2020/09/08 HARIKIRI(MR) )。
1. Snapshot Replicationの運用
小さなトラブルのためには、日頃から小まめなバックアップをして、また、復旧も迅速にするために活用します。バックアップ先はローカルにします(一般的な使用ではそれしかない)。
例えば「web」フォリダーをバックアップ元すると、バックアップ先には「#snapshot」というフォルダーが作成されます。設定したスケジュールでスナップショットは、この「¥web¥#snapshot」ローカルフェルダーに、スケジュールされた日時を表すフォルダー名で作成されていきます。
日々の大きなバックアップは、Hyper Backupに任せます(毎日)が、Snapshot Replicationによるスナップショットの間隔は、Hyper Backupより短い方がよいです。例えば1時間や2時間、5分毎も可能です。#snapshotフォルダーは、Hyper Bacvkupによるバックアップ対象のフォルダーではありません。従って、Hyper Backupのバックアップ先には、#snapshotフォルダーは含まれません。
2. Hyper Backupの運用
おすすめは、Synology NASにHDD毎に独立の電源スイッチがある裸族のお立ち台を接続(USB4台)して、毎日のパックアップ、パックアップ完了後のアンマウントしてオフラインにする設定が安全面からベターでです。
ただし、バックアップの後の次のパックアップには、HDDケースのスイッチのOFF/ON操作が必要になります。こまめなOFF/ONは必要とは思わないので、気づいたときにOFF/ONする運用でもよしとします。ただし、バックアップ先のHDDが再マウントされていないため、HDDがオンラインにならないとバックアップは失敗します。HDDのOFF/ONによりマウントされている場合は、その時に限りバックアップされます。この点は注意してください。
3. 自動化
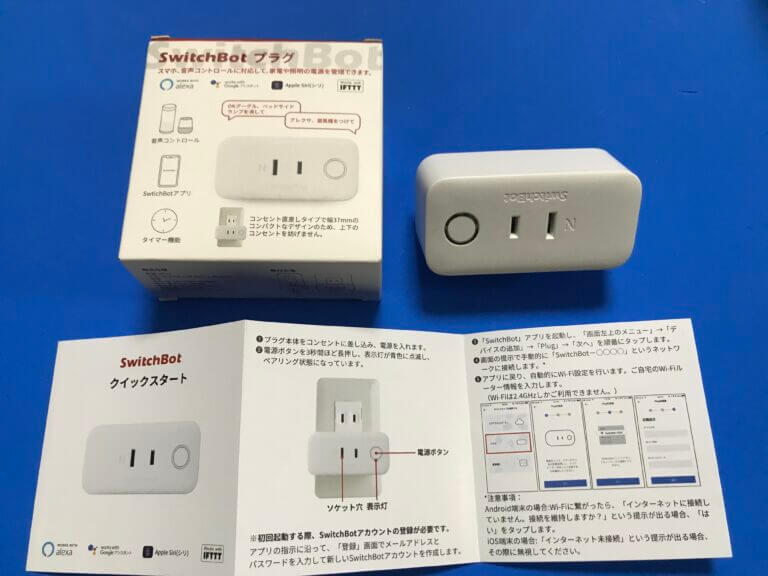
当サイトでも記事にしている「Switch Bot」シリーズの「プラグ」を用いて、外付けHDDケースの電源をコントールしバックアップの自動化を行う。これにより、手動によるHDD電源のオン/オフは不要となり、不必要な時間帯での外付けHDDケースの稼働が避けられることで、セキュリティ向上につながる。
当サイトでも記事にしているSmart Botシリーズのプラグを、DS918+のUSBに接続した外付けHDDケースの電源プラグと家庭用コンセントの間に接続
iOS用SmartBotアプリからプラグの稼働時間を設定します
Hyper Backup、および Snapshot Repricationがバックアップするタイミングに応じた時間帯に設定します
設定する時間帯の開始と終了の時刻は、5分から10分程度の余裕時間も考慮します
設定した通りに、外付けHDDケースに対してバックアップできているか、ログを確認します
WD BlueTM (5400 RPM Class)
2年保証
3.5 inch
Win/Mac対応
4Kセクタ(AF)
SATA, 5Gb/s
5400 rpm
イメージバックアップソフト(無料ダウンロード), Acronis True Image WD Edition (Windows版)
NoTouchTM ランプロードテクノロジー搭載: 記録ヘッドがディスクの表面に触れないように安全に配置されており、データを保護する
USB Copy
もっと柔軟なバックアップには,USB Copyも活用できます.
DS918+/DS920+では,全面とは背面に,1つずつUSB 3.0ポートがあります.外付けHDDにフォルダ/ファイルをコピーすることができます.
コピー動作のトリガー
USBデバイスのホットプラグしたとき
ハードウェアコピーボタンを押したとき
スケジュールを有効にして,その稼働時期になったとき
モード
高度なオプション
インクリメンタで以下のオプションが使用できる
送り先フォルダーの元のファイル構造を削除
ファイルの競合ポリシー
コピーが完了したら,そーすファイルを削除
マルチバージョンで以下のオプションが使用できる
ローテーションポリシーオプション
古いバージョンからローテーション
Smart Recycle
最大65535のバージョン保存
タスクが完了するとUSBデバイスは安全に自動排出される
フィルター機能が使える
ログ作成機能
通知機能
ビープ音
USB Copy — Synology サイト —
USB Copy の仕様 | Synology Inc.
PC/Macなどのバックアップ
以下のActive Backup Suiteによるバックアップに関するる記載は,古くなっています.2023年現在,Active Backup Suiteは,名前を変えてActive Backup for Bisunessとなりパワフルになりました.
以下の内容は古いですが,記載内容は残しておきます(2023/10/08)
Active Backup for BisunessでPC/Macをバックアップする方法は,別の記事を参考にしてください.
https://harikiri.diskstation.me/synology/42352/(新しいタブで開く)
Active Backup suite (古い,2023/10/08現在)は,Synology NAS以外のマシンのバックアップをSynology NASにすることを可能にします。
Synologyが提供するライセンスフリーのバックアップバッケージは、SMB、rsyncによりSynology NAS以外のマシーンのデータやシステムをバックアップすることができるようになります。
Windows 10 PCのデータ、システムのバックアップと復元
バックアップは、Synology NASをバックアップする同様の技術で、差分バックアップすることでバックアップ容量を削減できる リストアでは、CDやUSBメモリーで起動して、バックアップデータを保存しているSynology NASに接続することで、指定の復元ポイントに戻すことができる
ファイルサーバー 仮想マシン
Active Backup Suite – Synology Site –2023/10現在,Active Backup for Bisunessと名前を変えてパワフルになりました.以下の記述とリンクは参考までに止めてください )
Active Backup は、VMware、Hyper-V、Windows エンドポイント、Microsoft 365、G Suite のバックアップタスクを Synology NAS で一元管理し、一台のシンプルなコンソールで管理できるようにします。高速で信頼性の高いリカバリを実現し、実行中のサービス、VM、およびファイルを即座に利用できるようにします。
具体的には、Active Backup for BuisinessパッケージをSynology NASにインストールし、Windowsをバックアップしたい場合は、Windows10用のエイジェントをPCにインストールするところから始まります。
https://www.synology.com/ja-jp/dsm/feature/active_backup_suite
Active Backup for Businessの簡単な使い方
PC/MacにはAgentアプリをインストールしておく
このAgentからはバックアップのスケジュール設定はできないので,NASのサーバーアプリから設定すること.
Synology NASに”Active Backup for Bisuness”をインストールする.
左のメニューからWindows/Macの場合,PC/Macをクリック
WindowsかMacの何れかのタブをクリック
バックアップタスクを作成するために「作成」をクリックして編集
以上でPC/Macはスケジュールとルールに従いバックアップされる
スケジュールの変更
NASにあるサーバーアプリの”Active Backup for Bisunessを開く
左のメニューからWindows/Macの場合,PC/Macをクリック
WindowsかMacの何れかのタブをクリック
既に作成されているデバイスをクリックすると,タスク名が表示される.
表示されたタスクをクリックすると画面が変わり,タスク名やデバイス名のリストが表示される
編集タブが表示され有効になっているので,編集をクリック
ダイアログが現れるので,ルールやスケジュールを編集する
以上
システム・バックアップ
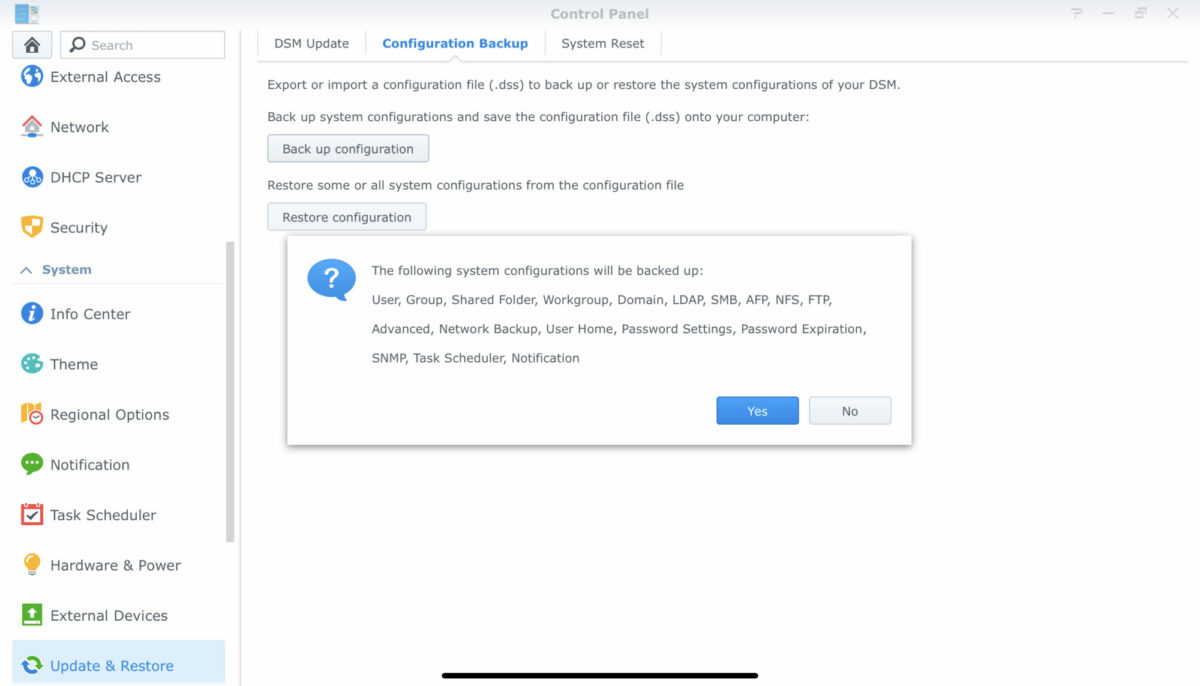
以下で説明する「システム・コンフィグレーション」のバックアップは、Synology NASシステムの各種設定 についバックアップすることが可能です.システム障害が起こった時に、できるだけ最小限の復旧作業で済みます。
以下挙げた項目がバックアップされます。以下の図のように、拡張子が、「dss」のシステム・コンフィグレーション」ファイルをダウンロードし,その時まで安全に保管しましょう。
ユーザー
グループ
共有フォルダー
ワークグループ
LDAP
SMB
AFP
NFS
FTP
Advanced
ネットワークパックアップ
ユーザーホーム
パスワード設定
パスワード期限
SNMP
タスクスケジュール
ノーティフィケーション
最終防衛線はクラウドか!
以上,バックアップしたデータの保管場所(サイト)を自宅にするという前提で解説してきました.即ち実データとバックアップデータが同じ場所という設定でした.実データとバックアップデータが同じ場所にあるということは,もしも,侵入者が実データを奪取できたとした時,同じ場所にあるバックアップデータも危険に曝されていることになります.
そこで,考えられるのは,バックアップデータを保管を他サイトにするという提案です.それが,今後の在り方なのかも知れません.でも,個人的には少し抵抗がありますが,暗号化したバックアップデータであれば,少し積極的にはなれそうです.
クラウドサービスは,どこでもよいのですが,例えば,マイクロソフトのOne Drive,AppleのiCloud,それとSynologyが提供するC2 Storage,等があります.クラウドサイトの地域は,Synology C2では,ヨーロッパ,北米,台湾です.One Driveおよび iCloudは,日本だと思われますが公表されているのかは不明です.
Synology C2のアドバンテージは,Synology NASの機能に沿ったサービスが提供されます.C2の価格は,以下のリンクから確認できます.
C2 Storageの価格 – Synology
https://c2.synology.com/ja-jp/pricing/storage
まとめ
Snapshostによるバックアップは、ランサムウェア対策に使われることが多いと聞きます。短い間隔での差分バックアップであるため、最も近い過去での最新バックアップを持っているためです。
ベースとなる「まるごとバックアップ」は、Hyper Backupに任せて、そのHyper Backupのバックアップ間隔の隙間を埋めるのが、Snapshot Replicationです。
最後に、バックアップと共に、セキュリティとして重要であるのが、データの漏出の防止です。その為には、暗号化についても考える必要があります。もしも、Synology NAS を使用しているのであれば、暗号化 について以下の記事もご覧ください。
編集履歴
2019/12/01 はりきり(Mr)
以上
DS920+https://www.synology.com/ja-jp/products/DS920+
![[抗体医薬] デュピクセント; dupilumab – アトピー性皮膚炎 – Regeneron/Sanofi、個人的には画期的な医薬品と思ったが、薬価はそうは判断していない – ID3809 [2020/05/21]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2019/12/F69B86AB-01B9-484D-A8BC-4B76C783EF5D.jpeg)
![[Synology] Router 「RT2600ac」- ネットワーク攻撃にも余裕でブロック – ET WEB_SPECIFIC_APPS ECSHOP user.php SQL INJECTION via Refererとは](https://harikiri.diskstation.me/myblog/wp-content/uploads/2019/12/B8081431-0E30-4AB5-AF21-9C14AD1FA69C.jpeg)
![[Synology] NAS (DS918+/DS920+)の バックアップを考える – システム構成は「Hyper Backup」、「Snapshot Replication」および「Synology Drive」- Smartプラグによる外付けHDDケース電源の管理によるセキュリティ向上、最後にシステムコンフィグレーション /クラウドバックアップ,Active Backup for Bisunessの設定も追記 [2023/11/15][2025/03/18]追記]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2019/12/00CC5DF8-4035-4F1B-A0C7-2AED96D62EDD.jpg)



![今日の英語 – しなければならない – must/have to ; しなくて良い – don’t have to [2019/11/29]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/11/F12C8F86-A0B0-4334-9DAD-E75022893870.jpeg)
![気になる企業 – WuXi Biologics – 生産能力を精力的に拡大中 – ID3693 [2020/07/14]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2019/10/B4F24978-42E9-477E-92B0-94605AEBEAB4.jpeg)
![気になる企業 – ABEC、バイオリアクター供給メーカー、日本ではあまり知られていない [2019/11/24]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2019/12/4FC26D27-31EC-4642-9022-AC54E52E1C0E-1200x838.jpeg)






![[Trip] 日本基督教団大阪教会をフランシスコ教皇の来日(2019/11/24)に合わせて紹介します [2019/11/24]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2019/11/A4E26DAD-5AFC-456A-976B-12353BAD6667-e1579579063380.jpeg)














