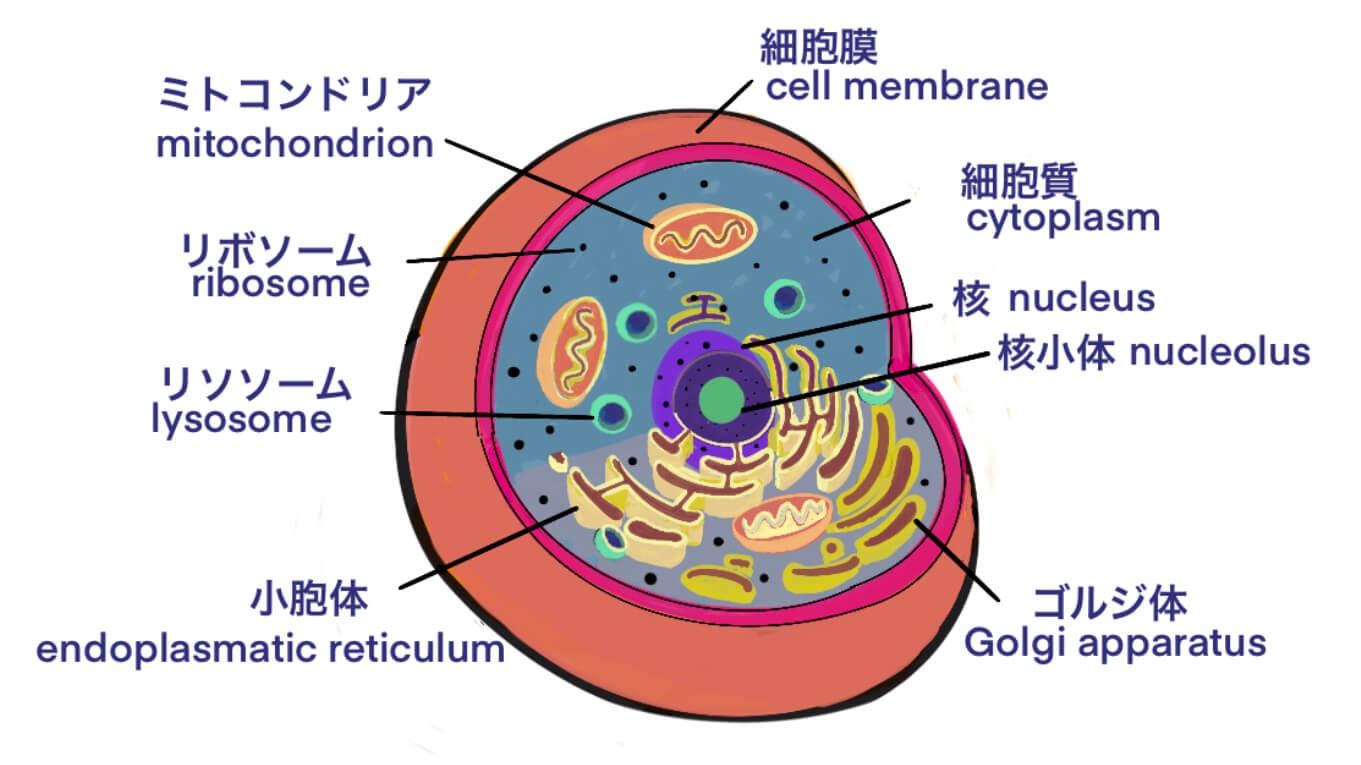
はじめに
Comparability(同等性評価)は、バイオ医薬品の製造工程や生産細胞株の変更時に、製品の品質、安全性、有効性に影響がないことを科学的に示すために実施される評価である。ICH Q5Eは変更の影響をリスクベースで評価する枠組みを提供し、Q6Bは比較すべき品質属性(構造、純度、活性、安定性など)とその試験方法を詳細に示す。CTDモジュール3では、比較性データは主に3.2.P.5.6と3.2.R.2に記載され、旧株と新株で製造された製品のCQA(重要品質特性)を3ロット以上用いて評価する。応力試験(stress testing)も含まれ、品質差異が臨床的に意味のない範囲であることを示すことが求められる。比較性が示されない場合は非臨床・臨床試験の再実施が必要となる。Comparabilityは単なる品質試験の一致ではなく、医薬品の本質的な一貫性と信頼性を確保する重要な手段である。
ICH Q5D(生物薬品製造用細胞基材の由来,調製及び特性解析)は、バイオ医薬品の製造において「生産細胞の起源とその特性を明確に定義し、コントロールすること」を要求するガイドラインです。
特に「生産細胞の変更(新たな細胞株への切り替え)」が行われた場合には、**同等性(comparability)**の評価が必要になります。ただし、Q5Dは細胞株の「由来」と「特性」についての要件を主に述べており、製剤の同等性そのもの(Q5EやQ6Bで扱う領域)まではカバーしていません。
この点を踏まえて、生産細胞の種類別に同等性確認の必要性と注意点を以下のように整理して解説します:
◆ 生産細胞の種類別の比較とICH Q5Dの位置づけ
| 細胞の種類 | 例 | Q5Dでの主な要件 | 新規作製時の注意点 | Comparabilityが必要になる理由 |
|---|---|---|---|---|
| ① 動物細胞(哺乳類) | CHO、NS0、HEK293 | ● 出所、バンク化(MCLB/WCB) ● 微生物学的試験(マイコプラズマ、ウイルスなど) ● 特性解析(遺伝的安定性など) | →細胞バンクの再構築が必要 →品質特性(糖鎖・翻訳後修飾)が変化しやすい | ● 翻訳後修飾が変わる可能性 ● 宿主由来不純物の変動 →製品のCQA(Critical Quality Attributes)への影響が大 |
| ② 微生物(細菌・酵母) | E. coli, Pichia | ● プラスミドの安定性確認 ● 毒素産生性の非存在 ● バンク管理(原核の場合も必要) | →挿入配列の完全性確認 →エンジニアリング変更時の再評価 | ● 発現量・可溶性の変化 ● エンドトキシンや不溶性凝集体の形成 |
| ③ 昆虫細胞 / ウイルス感染系 | Sf9 + バキュロウイルス | ● ウイルスベクターの構成確認 ● 細胞およびウイルスの安定性評価 ● 感染比などのコントロール | →ウイルス再構築時にはウイルスバンクの確立が必要 →共感染時はMOI(Multiplicity of Infection)管理が鍵 | ● 感染効率・発現量の変動 ● ウイルス不純物残存リスク |
| ④ 原虫 / 植物 / その他 | トリパノソーマ、タバコ細胞(植物ベース)など | ● 特殊な由来のため、特定病原体のリスク管理(Q5Aに近い) ● 植物であれば種子バンクなどの整備 | →表現型変異が大きく出る可能性あり →通常のICH Q5Dプロトコルが一部非適用 | ● 新たなアレルゲン性の懸念 ● 蛋白修飾プロファイルが大きく変化しやすい |
◆ 比較される属性(同等性検証の観点)
生産細胞を新たにした場合、ICH Q5Dに加え、以下のようなガイドラインも適用されます:
| 検証対象 | 関連ICHガイドライン | 内容 |
|---|---|---|
| 製品の品質(構造・活性) | ICH Q6B | → タンパク質の同一性、糖鎖構造、活性、純度などを比較 |
| バイオロジクス変更後の同等性 | ICH Q5E | → セルバンク変更も含めて製造プロセスの変更時に適用される |
| 安全性(ウイルス等) | ICH Q5A(R1) | → 宿主細胞起因のウイルスなど、ウイルスクリアランスの再評価が必要 |
◆ まとめ:Q5Dは起点、比較の終着点はQ5E・Q6Bへ
- ICH Q5D は「どのように細胞を由来・構築・保存・試験すべきか」の枠組みを提供するもの。
- 実際に細胞が変わった際に必要な「比較(Comparability)」の評価は、Q5E(変更時の影響評価)やQ6B(品質比較)の観点でより詳細に評価されます。
- 細胞種により、変更が製品に及ぼす影響の大きさが異なるため、比較の設計と深度は異なります。
~メンバー専用 ↓
~~~~~~~~~~~~~~~~~~~
↑ メンバー専用~
無料登録は右の握手ボタンからかできます.
~メンバー専用 ↓
~~~~~~~~~~~~~~~~~~~
↑ メンバー専用~
無料登録は右の握手ボタンからかできます.
ChatGPT: ご指摘のとおり、動物細胞(例:CHO細胞など)を用いて新たに組換えを行い、別の生産株(cell line)を樹立する場合、旧株と新株の「比較可能性(comparability)」を科学的に証明することは非常に難易度が高いとされています。
以下では、その実績と困難さの背景、そして実際に生産株を切り替えた事例を含めて解説します。
◆ なぜ生産株の変更はcomparabilityが困難なのか?
理由①:製品の特性が細胞依存である
- 生物学的製品(バイオ医薬品)は細胞に依存するプロセスで製造され、タンパク質の糖鎖修飾・立体構造・凝集性などに細胞由来のバリエーションが出やすい。
- CHO細胞ですら、クローンが変わると糖鎖構造が異なり、抗原性や安定性が変化することもある。
理由②:QbD以前の開発ではプロセス理解が浅い
- 古い製品ではQbD的視点(QTPP、CQA、CPPなど)に基づいた製品特性の同定と管理が十分に行われていないことが多く、比較の基準点自体が曖昧。
- 従って、新株が作った製品との品質同等性を客観的に示しにくい。
理由③:ウイルス安全性評価(Q5A)や免疫原性の懸念
- 新株は新たなウイルスクリアランス評価を必要とし(ICH Q5A)、時間・コストともに大きな再開発的負担が発生。
- さらに糖鎖パターンや凝集体の差異から免疫原性(ADA)の違いが出る可能性もあり、非臨床・臨床評価の再実施が求められる場合もある。
◆ 生産株切替の実績と事例
✅【実例1】Genentech社(抗体製剤)
- 最も有名な例は、Genentech社の抗体製剤「Rituximab(リツキサン)」におけるcell line切替。
- 当初の株から製造性改善のため、新たなCHO細胞クローンに切り替えを計画。
- 非常に慎重なcomparability評価(Q6B準拠:糖鎖、等電点、活性、凝集体、ADCC活性など)を実施。
- 米FDAはこれを承認。ただし、追加の臨床試験を限定的に要求された。
✅【実例2】Amgen社(エリスロポエチン製剤)
- 生産性の改善と品質変動の安定化を目的にEPO製剤の生産株を変更。
- 新旧製品での同等性確認において、生物活性と糖鎖プロファイルの比較が中心となった。
- EMAは本件を比較性の成功事例として報告している。
◆ 承認されるための比較戦略(成功の鍵)
| 比較対象 | 評価内容 | ガイドラインとの関係 |
|---|---|---|
| 構造比較 | 一次構造、二次構造、糖鎖、等電点、凝集体 | ICH Q6B |
| 機能比較 | リガンド結合活性、中和活性、ADCC/CDC活性 | ICH Q6B |
| 安定性 | 安定性プロファイル(加速、長期) | Q1A/Q5C |
| 安全性 | 宿主細胞由来不純物、ウイルスリスク | ICH Q5A(R1) |
| 臨床的影響 | 免疫原性、PK/PDの比較(必要に応じ) | ICH Q5E、EMA/FDAのバイオ後続品指針と類似 |
◆ まとめ:新しい生産株への切り替えは「事実上の新製品開発」に近い
- 細胞株の違い=製品の違いになり得るため、comparabilityだけで済ませるのは困難。
- ICH Q5D → Q6B/Q5E/Q5Aなど多方面からの総合評価が必要。
- 承認事例はあるものの、基本的には例外的措置として当局が受け入れているケースが多く、戦略的・科学的根拠と慎重なプロセスが不可欠です。
~メンバー専用 ↓
~~~~~~~~~~~~~~~~~~~
↑ メンバー専用~
無料登録は右の握手ボタンからかできます.
~メンバー専用 ↓
~~~~~~~~~~~~~~~~~~~
↑ メンバー専用~
無料登録は右の握手ボタンからかできます.
ChatGPT: 以下に、動物細胞を用いた生産株の切り替えに関する実例と、それぞれの詳細情報が記載された信頼性の高い情報源のURLをご紹介します。
1. Amgen社によるエポエチンアルファ(EPO)製剤の生産株変更事例
Amgen社は、エポエチンアルファ(Epogen®)の製造プロセスを変更し、新たな生産株を導入しました。この変更に伴い、製品の品質属性(例:糖鎖修飾)にわずかな差異が生じましたが、非臨床および臨床試験を通じて、これらの差異が臨床的に有意でないことが確認されました。この事例は、製造プロセスの変更が製品の品質や安全性に与える影響を評価する上での重要な参考となります。サイエンスダイレクト+1ResearchGate+1
2. Genentech社によるリツキシマブ(Rituxan®)の製造プロセス変更事例
Genentech社は、リツキシマブの製造プロセスを変更し、新たな生産株を導入しました。この変更により、製品の品質属性にわずかな差異が生じましたが、詳細な分析および非臨床・臨床試験を通じて、これらの差異が製品の安全性や有効性に影響を与えないことが確認されました。この事例は、製造プロセスの変更が製品の品質や安全性に与える影響を評価する上での重要な参考となります。
これらの事例は、製造プロセスや生産株の変更が製品の品質や安全性に与える影響を評価する上での重要な参考となります。また、ICHガイドライン(例:Q5E、Q6B)に基づく比較性評価の実施が、規制当局からの承認を得る上で不可欠であることを示しています。
~メンバー専用 ↓
~~~~~~~~~~~~~~~~~~~
↑ メンバー専用~
無料登録は右の握手ボタンからかできます.
~メンバー専用 ↓
~~~~~~~~~~~~~~~~~~~
↑ メンバー専用~
無料登録は右の握手ボタンからかできます.
ChatGPT: 非常に重要なご質問です。ICH Q5EおよびQ6Bは、バイオ医薬品において製造プロセスの変更(特に生産細胞の変更のような本質的変更)に際し、その影響の科学的評価と比較の方法論を提供しています。
以下に、ICH Q5EとQ6Bの観点に基づいた詳細な比較評価の方法について体系的に解説します。
◆ ICH Q5E の観点:「変更による影響の科学的評価」
正式名称:Q5E – Comparability of Biotechnological/Biological Products Subject to Changes in Their Manufacturing Process
✦ 適用範囲
- 製造プロセスの変更(例:生産株の変更、培養プロセス変更、精製条件変更など)
- 承認前後どちらにも適用
✦ 核となる考え方:“Comparability exercise”(比較性評価)
「変更があっても、品質、安全性、有効性に影響がないことを科学的に示す必要がある」
❶ 【比較の3階層】Q5Eの原則
| 比較レベル | 内容 | 評価方法 |
|---|---|---|
| 品質属性の比較 | 主成分の構造・活性・不純物プロファイルなど | 試験法(ICH Q6Bに準拠)で測定 |
| 非臨床的比較 | 活性・毒性・薬力学(必要に応じ) | In vitro / In vivoモデルで確認 |
| 臨床的比較 | PK/PD、免疫原性、安全性、有効性(必要に応じ) | 臨床試験(縮小・限定的) |
🔍 非臨床・臨床の段階に進むかどうかは、「品質属性の比較」での差異の有無・影響度で決定
❷ Q5Eで求められる「比較性戦略」の構築要素
| 要素 | 内容 |
|---|---|
| 変更の概要 | 旧→新のプロセス差異、変更理由 |
| リスク評価 | 製品属性(CQA)への影響を予測し、リスクに応じて試験戦略を設計 |
| 承認当局との対話 | サイエンスベースの判断を下すために相談が推奨(e.g. Scientific Advice) |
◆ ICH Q6B の観点:「品質属性の詳細な比較」
正式名称:Q6B – Specifications: Test Procedures and Acceptance Criteria for Biotechnological/Biological Products
Q6Bは**「比較の実際の方法論」=何をどう試験・比較するのか**を示すガイドラインで、Q5Eの「品質比較」の根幹を成します。
❶ 【比較すべき品質項目】(主に12領域)
| 分類 | 主な評価項目 | 目的 |
|---|---|---|
| 構造 | アミノ酸配列、糖鎖構造、ジスルフィド結合、等電点 | 分子の一貫性 |
| 物理化学的特性 | 分子量、電荷、構造安定性 | 物性の変化を確認 |
| 純度および不純物 | 主成分の純度、凝集体、不溶性物質、宿主細胞タンパク質(HCP)、DNA残留など | 安全性・安定性の確保 |
| 生物活性 | 受容体結合活性、酵素活性、中和能 | 作用機序に影響しないか |
| 免疫学的性質 | ELISAなどで抗原性確認 | 免疫原性のリスク評価 |
| 安定性特性 | 長期安定性、加速劣化、応力試験 | 扱いや保存性への影響 |
❷ 評価の具体的手法と判断基準
| 評価項目 | 評価内容 |
|---|---|
| ① 許容限界の設定 | 製品ごとのCQAに応じて、許容できる変動幅(範囲)を設定 |
| ② 統計的手法 | 統計的に意味のある差異か(p値よりも臨床的意義に着目) |
| ③ 再現性と一貫性 | ロット間変動や製造スケールに伴う差異も加味 |
| ④ 必要に応じた補完試験 | 生体内評価、PK/PD、臨床再確認など |
◆ Q5E × Q6Bでの比較性評価フロー(まとめ図)
生産株変更 →
Q5E:変更の影響分析
└→ Q6B:品質比較(構造・活性・安定性・不純物)
├→ 差異なし or 許容範囲 → 承認維持可能
└→ 差異あり → 非臨床/臨床評価の追加(再申請相当)
◆ 補足:各評価の対象となる代表的CQA(例:抗体製剤)
| CQAカテゴリ | 具体例 | 評価対象となる理由 |
|---|---|---|
| 構造 | 糖鎖パターン(G0F, G1F 等)、酸化部位 | 免疫原性、活性、半減期に影響 |
| 不純物 | HCP、DNA、凝集体 | 安全性に直接関与 |
| 機能 | ADCC、CDC、中和活性 | 有効性の指標 |
| 安定性 | 凍結融解後の活性保持率 | 製品の取り扱い条件設定の根拠 |
◆ 結論
- Q5E は「変更に伴う影響評価とリスクベース戦略の枠組み」
- Q6B は「具体的に比較すべき品質項目と試験方法のマニュアル」
- この2つを組み合わせて、生産株の切り替えなど重大な変更の科学的裏付けが求められます。
~メンバー専用 ↓
~~~~~~~~~~~~~~~~~~~
↑ メンバー専用~
無料登録は右の握手ボタンからかできます.
~メンバー専用 ↓
~~~~~~~~~~~~~~~~~~~
↑ メンバー専用~
無料登録は右の握手ボタンからかできます.
ChatGPT: はい、ご指摘ありがとうございます。
ICH Q6Bで示される「安定性特性の評価」の中の「応力試験(stress testing)」とは、バイオ医薬品の分子がどのような条件で分解・変性・失活するかを意図的に調べるための試験です。これは通常の安定性試験(長期・加速)とは異なる目的を持っています。
◆ 応力試験(Stress Testing)の定義と目的
✦ 定義(Q6B準拠の解釈)
“Stress testing is intended to assess the inherent stability of the molecule by exposing it to conditions more severe than those encountered during manufacture, storage, or use.”
つまり、通常使用では起きないような強い環境下に晒すことで、その医薬品の分解経路や分解物を特定するための試験です。
◆ 応力試験で用いられる典型的な条件
| 応力条件 | 試験目的 |
|---|---|
| 高温(例:40–60℃) | 熱による変性・分解の評価 |
| 極端なpH(酸性/アルカリ) | 酸加水分解・塩基性加水分解などの化学的不安定性の検出 |
| 酸化剤(H₂O₂ など) | メチオニン酸化やトリプトファン酸化のリスク評価 |
| 光(UV/可視光) | 光分解や構造変化のリスクを評価(ICH Q1Bと併用) |
| 冷凍・凍結融解サイクル | バイオ医薬品特有の凝集・沈殿・活性低下の評価 |
◆ 応力試験の役割
- 分解経路の特定
- 例:メチオニンの酸化、デアミネーション、アスパラギンのイソアスパラギン酸化など
- 安定性示差の比較に活用
- 旧製品 vs 新製品(例:新しい生産株)で、同様な分解パターンを示すかを確認
- 安定性指標(Stability-indicating Assay)の検証
- 応力試験後に分解生成物を検出できる分析法(SEC、CE-SDS、RP-HPLCなど)の妥当性評価
◆ 応力試験と他の安定性試験の違い
| 試験種別 | 目的 | 条件 | 結果の扱い |
|---|---|---|---|
| 長期安定性試験 | 実使用条件での安定性評価 | ICH Q1A/Q5C条件(例:5±3℃、25℃/60%RH) | 製品の使用期限決定などに用いる |
| 加速安定性試験 | 劣化促進による傾向把握 | 40℃/75%RHなど | 予測モデルに使用される |
| 応力試験(stress testing) | 分解機構の調査・差異評価 | 通常よりも厳しい条件 | 分解物の特定、比較性評価に重要 |
◆ 応力試験はComparabilityにも重要
生産株の変更があった場合、製品の安定性が変わるかどうかを比較する強力な手段として、以下のような応力条件下で両製品を並行評価します:
- 旧生産株製品 vs 新生産株製品
- 応力条件で放置 → 分析法で主成分と不純物プロファイルを比較
このようにして、品質属性が安定性の面でも同等であるかを実証できます。
◆ 参考:ICHガイドライン内の位置づけ
- ICH Q6B:応力試験を「構造的完全性や分解物の特性評価の一部」として明記
- ICH Q5C:バイオ医薬品の安定性試験全体を規定する中で、応力試験を明確に規定(Stability-indicating test method)
~メンバー専用 ↓
~~~~~~~~~~~~~~~~~~~
↑ メンバー専用~
無料登録は右の握手ボタンからかできます.
あなた:
~メンバー専用 ↓
~~~~~~~~~~~~~~~~~~~
↑ メンバー専用~
無料登録は右の握手ボタンからかできます.
ChatGPT: ご質問の「応力試験」は、英語では一般的に以下のように表現されます:
✅ 英語表現:
Stress Testing
◆ 用法の例(ICHガイドラインでも使用)
- ICH Q6B(品質仕様に関するガイドライン)より: “Stress testing can help to identify the likely degradation products, which can in turn help to establish the degradation pathways and the intrinsic stability of the molecule.”
- ICH Q5C(安定性試験)でも使用: “Stress testing of the drug substance can help identify the degradation pathways and the intrinsic stability of the molecule.”
◆ 類義表現(目的によって異なるニュアンス)
| 日本語表現 | 英語表現 | 備考 |
|---|---|---|
| 応力試験 | Stress testing | 最も一般的で正式な表現。ICHガイドラインでも使用。 |
| 強制分解試験 | Forced degradation studies | 「Stress testing」と同義で使われることも多い(特に業界実務) |
| 分解試験 | Degradation studies | 一般的な用語だが、必ずしも過酷条件を意味しない場合がある |
◆ 補足:
- 「Stress testing = 応力下での安定性の境界を探る試験」
- 「Forced degradation = 分解を強制的に起こさせて経路や不純物を特定する試験」
これらは実務上はほぼ同義として扱われますが、文書や報告書では「stress testing」が公式な表現として推奨されます。
必要に応じて、「stress testing」の記述例(CTDモジュール3や査察対応資料の中の記載フォーマット)も提供可能ですので、お気軽にどうぞ。
~メンバー専用 ↓
~~~~~~~~~~~~~~~~~~~
↑ メンバー専用~
無料登録は右の握手ボタンからかできます.
ChatGPT: はい、CTD(Common Technical Document)のモジュール3は「品質に関する情報」を記載するパートであり、**生産株の変更を含む製造プロセスの変更に対する比較性評価(comparability exercise)**もここに記載されます。
以下では、CTDモジュール3における比較性評価の構成と記載の実際について、具体的に解説します。
◆ 1. 比較性評価が記載されるCTDの構成位置
CTDモジュール3の中で、比較性評価が記載される主なセクションは以下のとおりです:
| CTD構成番号 | セクション名 | 内容 | 比較性評価との関係 |
|---|---|---|---|
| 3.2.S.2 | 製造工程と工程管理(原薬) | 製造工程の変更(生産株変更含む)とそれに対する管理 | 変更前後の工程比較、理由、工程図 |
| 3.2.S.4 | 管理戦略(Control of Drug Substance) | IPC(工程内試験)や試験項目の変更有無 | 変更に基づく試験戦略の再構築の記載 |
| 3.2.S.7 | 安定性(原薬) | 応力試験、安定性試験による比較 | 変更の影響を示すデータ |
| 3.2.P.2 | 製剤の製造開発(製剤) | 製品の特性変動(例:糖鎖・凝集)への影響 | 製剤段階での比較性評価を記載 |
| 3.2.P.5.6 | 製品特性の比較試験(製剤) | 比較性データのメインセクション | 品質比較試験(Q6B準拠)のまとめ |
| 3.2.R.2 | 比較性評価レポート(任意項目) | Q5Eベースの総括的レポート | 詳細な比較性分析の全文書化(各種図表、リスク評価など) |
◆ 2. 実際の比較性評価の記載構成(3.2.P.5.6例)
以下は**3.2.P.5.6「Manufacturing Process Comparability Studies」**に記載される代表的構成例です:
❶ 概要(Executive Summary)
- 生産株変更の背景と目的(例:生産性向上、安全性向上)
- 変更の概要(旧株→新株の由来、培養条件等)
- 比較戦略(Q5Eに準拠したアプローチ)
❷ 品質比較データ(Q6B観点)
| 項目 | 評価指標 | 試験法 | 判定結果 |
|---|---|---|---|
| 構造 | アミノ酸配列、糖鎖パターン | LC-MS、CE-SDS | 一致または許容範囲内 |
| 純度 | 凝集体、分解物、HCP | SEC, HPLC, ELISA | 同等と判断 |
| 活性 | リガンド結合、細胞活性 | SPR, cell-based assay | 変化なし |
| 安定性 | 応力試験での変化傾向 | Stress/Accelerated test | 同様な分解プロファイル |
→ これらの結果を表形式や図解でまとめて記載し、「変更による品質の違いは臨床的に意味がない」と論証します。
◆ 3. 3.2.R.2における比較性評価レポート(詳細な補足資料)
ここには、以下のような**比較性評価の全文(Q5Eベース)**がまとめられます:
構成例:
- 目的・変更点の定義
- 品質属性(CQA)の同定と影響分析
- 各比較試験の詳細
- 分析法バリデーション(同一条件の比較性)
- 応力試験と安定性差異の評価
- 非臨床・臨床評価が必要かの判断
- リスクアセスメントの結論と根拠
📌 多くの場合、ここでは「全体を通じて安全性・有効性に影響しないと科学的に示せるか?」という観点で統合的議論が展開されます。
◆ 4. 補足:比較性評価の提出時の注意
| 観点 | 留意点 |
|---|---|
| 一貫性の証明 | 最低3ロット以上で比較(旧ロット vs 新ロット) |
| 分析法の整合性 | 同一条件・同一装置で試験。変更がある場合は再バリデーションが必要 |
| 当局との事前相談 | PMDA/FDA/EMAいずれもScientific Adviceの取得が推奨される |
| 結果の表現 | 単なる統計的同一性でなく、「臨床的に意味のある差異がない」ことを科学的に示す |
◆ まとめ
| 観点 | 内容 |
|---|---|
| CTDモジュール3の記載場所 | 主に3.2.P.5.6および3.2.R.2に比較性評価を記載 |
| Q5E/Q6Bに基づく記述内容 | 変更概要、品質試験の比較、安定性試験、影響評価など |
| 文書構成の特徴 | 表・グラフ・図解を多用し、定量的かつ総合的に議論する |
ICH Q5D: レジメ
Q5Dを参照する場合の具体例.
- 細胞株の作り直しによる同等性/同質性 (comparability)の確認.
Q5D 生物薬品製造用細胞基材の由来,調製及び特性解析 (2000)
DERIVATION AND CHARACTERISATION OF CELL SUBSTRATES USED FOR PRODUCTION OF BIOTECHNOLOGICAL / BIOLOGICAL PRODUCTS
関連ガイドライン
もしも,細胞株を作り直す場合,当該Q5Dの他に以下のQ5A, Q5Bも参照する必要がある.また,細胞株の変更と共に製造工程の変更がある場合, Q5C, Q5Eも参照する必要がある.試験法はQ6Bを参照する必要がある.
- Q5A, ウイルス安全性 : 「ヒト又は動物細胞株を用いて製造されるバイオテクノロジー応用医薬品のウイルス安全性評価」(2000)(ICH Q5Aガイドライン:平成12年2月22日付 医薬審第329号 厚生省医薬安全局審査管理課長通知)を参考に実施する.
- Q5B, 塩基配列及びアミノ酸配列 : 「組換えDNA技術を応用したタンパク質生産に用いる細胞中の遺伝子発現構成体の分析」(1998)(ICH Q5Bガイドライン:平成10年1月6日付 医薬審第3号 厚生省医薬安全局審査管理課長通知)
- Q5C, 安定性 : 「生物薬品 (バイオテクノロジー応用製品/生物起源由来製品) の安定性試験」(1998)
- Q5E, 製造工程の同等性/同質性 : 「生物薬品 (バイオテクノロジー応用医薬品/生物起源由来医薬品) の製造工程の変更に伴う同等性/同質性評価」(2005)
目的 [1.1] Objective
以下が適切に実施されること
(1) ヒト,動物及び微生物由来の細胞株の調製 (セルバンクとなる候補となる細胞株)
(2) セルバンクの調製と特性解析
意義 [1.2] Rationale
従来から,細胞由来の生物起源由来医薬品の品質について考慮すべきポイントは以下の項目が挙げられてきた.
- 外来性因子の汚染の可能性
- 生産細胞の性質
遺伝子組換え医薬品においては,以下のポイントが挙げられる.
- 細胞基材中に含まれる遺伝子発現構成体に関する問題
以上のように医薬品の品質や安全性に影響を与える可能性があるため適切な管理が必要であることが広く認識されている.
適用対象 [1.3] Scope
(1) セル・バンク・システムを持つ全ての細胞基材 (cell substate)
(2) in vivo/ex vivoで投与 (診断目的は対象外)
参考 : 医療用語 「in vitro ⇔ in vivo 」は常識。 じゃあ「ex …
(3) 全ての後生動物由来 (metazoan, 多細胞動物の特徴を持つ生物)
(4) 連続継代性細胞株,寿命を有する正常二倍体細胞
(5) 微生物 (細菌,真菌,酵母),その他の単細胞
(6) 遺伝子治療用薬品/ワクチン製造目的セル・バンク
(7) 初代培養細胞(動物組織・器官)にて得られるウイルス・ワクチンなどはバンク化されていないものでも適用可能な項目.
(8) 除外 : 代謝産物 (抗生物質,アミノ酸,炭水化物,その他低分子),初代培養細胞由来生産物
留意事項 [2] GUIDELINES
1. 細胞基材の起源,由来及び履歴 [2.1]
Source, History and Generation of the Cell Substrate
得られる医薬品の品質及び安全性を保障するための総合評価として役立つ [2.1.1] はじめに Introduction.
- 細胞基材(親株,生産株)の履歴とその妥当性
- 研究開発段階での事象(入念な記録)
- 履歴及びその調製 (以下の情報が欠如していることだけで承認されないことはないが,他の特性解析などの情報による補完が必要となる)
細胞の起源,由来及び履歴 [2.1.2] Origin, Source and History of Cells
- 細胞基材のもととなる細胞がどこで樹立されたか
- どこから供給されたか (研究機関,細胞保存供給機関)
- 適切な科学文献の情報
- 直接的に供与された細胞であることが望ましい(文献情報でもよい)
ヒト細胞株の場合,ドナー情報として
- 出生地,
- 育成地,年齢,
- 性別,
- 健康状態 (病原体情報),
- 組織・器官)
ヒト正常二倍体線維芽細胞の場合,
- ドナー年齢は細胞株のvitro細胞寿命に影響するので可能な範囲で情報を入手.
動物細胞株の場合,
- 細胞腫,
- 系統,
- 繁殖条件,
- 組織または器官,
- 出生地や生育地,
- 年齢及び性別,
- 病原体に関する試験結果
- 健康状態
微生物の場合
- 種及び系統
- 遺伝型,
- 表現型などの特性.
- 病原性,
- 毒素産生性,
- その他バイオハザード情報
- 株樹立からの継代数
培養細胞の場合,
- 培養履歴 (細胞分離時の培養,in vitro培養,細胞株樹立時培養など物理的,科学的又は生物学的手法,遺伝子導入操作も含む)
- 細胞の同定,特性,
- 内因性及び外来性因子に関する試験結果
後生動物由来の連続継代性細胞株の場合,
- 培養期間
- 細胞数倍加レベル(PDL),
- 一定の希釈倍率と継代数 or 培養日数.
正常二倍体細胞株の場合,
- 全ての期間での性格なPDL
細胞基材の調製 [2.1.3] Generation of the Cell Substrate
細胞基材とはMCBの前段階から以降を指す.
- 感染性物質への暴露の可能性に関する捜査過程の詳細考察,
- 培地成分 (血清,酵素,加水分解物),
- ヒト又は動物由来成分の暴露 (生体成分の起源,調整及び管理方法,各種試験結果,品質保証情報,文献での引用でもよい)
- 以上の情報補は,当該医薬品のリスク/ベネフィットの評価の一部となる
- 親細胞株は,十分に特性解析されているものを選択することが望ましい
- 操作 (細胞融合,形質導入,セレクション,コロニーピックアップ,遺伝子増幅,培養環境,培地馴化)
- 組換えDNA技術応用医薬品では細胞基材は形質転換細胞でありクローニングされたものである(MCB前)
- 非組換え医薬品及び非組換えワクチンでは,細胞基材はMCB前の細胞
- ハイブリドーマ由来の医薬品のでは,細胞基材は,細胞融合後のハイブリドーマ細胞株
2. 細胞のバンク化 [2.2] Cell Banking
セル・バンク・システム[2.2.1]
Cell Banking System
- 利点は,製造毎ロットで特定解析されたセル・バンクを使用できること.
- 二段階方式 : MCB/WCB.
- 予想使用頻度,予想更新頻度,適格性の評価.
- クローニングは均一性の確保,特性解析試験(製造目的にかなえばクローニングは必要ない)
- 培養条件の違いがある (MCB/WCB, CB/実製造)
- 重要なことは : 特性解析されたCBによって一定品質の医薬品が得られること.
- 微生物発現系では,形質転換を改めて行って新しいCBの調製を行う場合がある.この場合,綿密に試験したHost CellとPlasmid Bankの使用,得られた形質転換体の試験の実施での同等な結果が前提となる.かられたCBは,MCBとみなせる.なぜなら,これら細菌や酵母の形質転換は,後生動物細胞の形質転換とは異なり,高い再現性を有するためである.
セル・バンク化の手法 [2.2.2] Cell Banking Procedure
細胞をバンク化する過程で予防策を講じる.
- 汚染されていない細胞基材の使用
- 合理的な保証 (細胞基材の信頼性をバンク化の過程で予防策として講じる)
- バンク・システムの種類
- バンクのサイズ (*2)
- 容器 (*2)
- 密封方法 (参照*2)
- 凍結保護剤 (*2)
- 培地 (*2)
- 凍結条件 (*2)
- 保存条件 (*2)
- 細胞生存率 (MCBの更新確認)
- in vitro細胞齢 (MCBの解凍時)
- 方法の記載 : 微生物汚染の回避,同一室内での他の細胞との交差汚染の回避,容器のトレーサビリティ,その際の文書化システム.保存容器のラベルの耐久性(ラベリングシステム).
- *2: バンク化手法 : 細胞の拡大培養,複数培養容器で得られた細胞のプールの実施.バイアル充填(無菌)と凍結および保管(気相,液相),凍結融解後の一定の細胞生存率の保持と医薬品製そ造品質の向上性.
- 災害対応 (火災,停電,人的過失)のためのセルバンクのマルチサイト保管,炭酸ガス自動補充システム,予備電源,自家発電システム.
3. セル・バンク・システムの特性解析及び品詞評価に際しての一般的留意事項 [2.3]
General Principles of Characterization and Testing of Cell Banks
- MCBでは,特性解析試験 Tests of Identity,純度試験 Tests of Purity は1回実施すべきである.
- WCBでは,一部の特性解析試験,純度試験は1回実施すべきである.
- ウイルス安全性は,「ヒト又は動物細胞株を用いて製造されるバイオテクノロジー応用医薬品のウイルス安全性評価」(ICH Q5Aガイドライン:平成12年2月22日付 医薬審第329号 厚生省医薬安全局審査管理課長通知)を参考に実施する.
- 培養期間中の細胞の安定性試験 Cell Substrate Stability は1回実施すべきである.
参照ガイドラインと解析
- 遺伝子組換え体細胞の場合は、「組換えDNA技術を応用したタンパク質生産に用いる細胞中の遺伝子発現構成体の分析」(ICH Q5Bガイドライン:平成10年1月6日付 医薬審第3号 厚生省医薬安全局審査管理課長通知)を、塩基配列及びアミノ酸配列解析のガイダンスとして参照すること。
- 前述のガイドラインは,非組換え体の細胞で配列が分かっている場合は同方法により塩基配列を解析することは有用である.
- 微生物ワクチン抗原やハイブリドーマの抗体ではこの解析は必ずしも必要ではない.
- しかるべき理由がある場合は,MCBにかえてWCBで特性解析,品質評価を実施しても良い.
以下の試験について,各細胞に適切な項目を選択して実施する.試験の詳細と結果を申請資料に記載する.
(1) 特性解析試験
- 一般的にMCBについて実施され,WCBでは一部が実施される.
- 適切な試験法を選択して実施する.
- 表現型,遺伝型が考えられる.
- 全ての試験を実施しする必要はない.
後生動物細胞の特性解析
- 形態解析
- アイソザイム解析
- バンディング細胞遺伝子学的手法
- 種特異的抗血清
- 細胞腫特定マーカー(染色体のバンディング解析)
- DNA解析(ゲノムの多型パターン (制限酵素断片長,繰り返し配列数,染色体中字ヌクレオチド繰返)
- 目的タンパク質発現試験.
微生物細胞の特性解析
- 選択培地中での増殖解析
- ファージ型分析
- プラスミド・バンク(ICH Q5B)
- 目的タンパク質発現確認)
(2) 純度試験
- 外来性の微生物因子・細胞の混入試験 (試薬・抗生物質の影響を考慮)
後生動物細胞の純度試験
- 細菌や真菌の否定試験: 全容器の1%,2本以上,pH.Eur, JP, USPに記載の微生物限度試験法)
- マイコプラズマ (寒天平板培地と液体培地による培養および指標細胞培養法,Ph.Eur, JP, “Points to Consider in the Characterization of Cell Lines Used to Produce Biologicals” (FDA, CBER, 1993): 1 vial使用で十分)
- ウイルス (汚染可能の正のある幅広い種類のウイルス検出を計画,ICH Q5Aを参考,WHO文書:生物薬品生産のための胴部細胞の使用に関する文書 2.3.4項)
- 他の細胞株汚染 (交差汚染の機会のリスクレベルで試験の選択,同一室内での開放状態,目的タンパク質が意図通りに得られるか)
微生物細胞の純度試験
- 外来微生物や細胞の混入試験
- バンク化した細胞の特性の考慮,科学文献,起源,培養法と材料から想定汚染,バンク化の室内で存在する他の生物の考慮,増殖可能/不可能培地の使用による観察:バンク化工程中での観察
(3) 細胞基材の安定性
- 意図した目的を果たすか
- 恒常的な生産
- 保存期間中の生産能力の保持
- 最小継代培養細胞,パイロットスケール又は実製造条件細胞齢,又はそれ以上の細胞齢でのデータは1回は必要
- 目的タンパク質が恒常的に生産されるか: 遺伝子又は得られたタンパク質の解析(生産性のみではない
- CB保存条件下での安定性 (治験薬製造過程でデータは得られ申請資料に記載する.CB安定性モニタリング計画の提出,承認書には製造率確認試験の間隔を記載,生存率に著名な変化が無ければ追加試験は必要ない)
(4) 核型分析及び像腫瘍性試験
- 遺伝学解析は単独での試験は必要ないが,特性解析試験および純度試験では適切であろう.像腫瘍性は既知論文で示せれば必要ない
- 生細胞存在の可能性がある生ウイルスワクチンの場合,この試験を行うこと.
- 詳細に解析・評価されているMRC-5細胞やWI-38細胞では,これら試験は必要ない.ただし,新たに調製されたもので二倍体であこと,予定の細胞寿命であることを一度確認すること.
試験方法は”WHO Requirements for the Use of Animal Cells as in vitro Substrates for the Production of Biologicals” (in WHO Expert Commitee on Bilogical Standardization 47th Report, WHO Technical Report Series No.878,1998).
用語
(1) In Vitro 細胞齢 (In vitro Cell Age)
MCB融解->Harvestまでの時間尺度 (培養期間,細胞倍加レベル(PDL) or 一定の希釈手順での継代の場合では細胞境内数)
(2) 親細胞 (Parental Cells)
(3) 後生動物 (Metazoan) : 多細胞動物の特性を持つ生物.
(4) 宿主細胞
4. 付録 初代培養細胞の細胞基材
生物薬品(バイオテクノロジー応用医薬品/生物起源由来医薬品)製造用細胞基剤の由来、調製及び特性解析 [43.13KB] (H12/7/14)
English Title : Derivation andf Characterisation of Cell Substrates Used for Production of Biotechnological/Biological Products.
https://www.pmda.go.jp/files/000156460.pdf
ICH : International Conference of Harmonization
編集履歴
2024/09/04 Mrはりきり
2025/04/17 事例追加(with AI)