art
は、一般的には「芸術」の意味です。英和辞典によれば、美術、芸術、芸術作品、人文科学、技術(わざ、こつ)などの意味もあります。
その他、関連して覚えておきたい単語を以下にリストしました。
- artist : 芸術家、画家
- artificial : 人工の
- artificiality : 人工、わざとらしい
編集履歴
2024/01/26 Mr.HARIKIRI
![[Kw] 今日の英語 半径/直径 art/美術、芸術、技術、人文科学](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/11/F12C8F86-A0B0-4334-9DAD-E75022893870.jpeg)
は、一般的には「芸術」の意味です。英和辞典によれば、美術、芸術、芸術作品、人文科学、技術(わざ、こつ)などの意味もあります。
その他、関連して覚えておきたい単語を以下にリストしました。
2024/01/26 Mr.HARIKIRI
![[Kw] 今日の英語 半径/直径 radius/diameter](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/11/F12C8F86-A0B0-4334-9DAD-E75022893870.jpeg)
は、radiusとdiameterですが、数学では縁の面積を「πr2」と表しますね。diameterの「D」は数学では出てきこないと思いますが、バイオ医薬品の精製に使用するカラム、分析用カラムのサイズを表す時に直径「D」は使用します。
2024/01/26 Mr.HARIKIRI
![[Cafe] Greenberry’s COFFEE Co.は大阪の蒲生4丁目店](https://harikiri.diskstation.me/myblog/wp-content/uploads/2024/01/IMG_8837.jpeg)
というのは、蒲生4丁目のこと。大阪は京橋駅の国道1号線を上るとガモ4交差点に行き着く。ガモ4交差点の角ビルの3FにGreenberry’s COFFEEがある。
2024/01/26,
11:30まであるモーニングセットを頂いた。今はプー太郎だから時間は結構あったりする。心の余裕は沢山無いけども。まあ少しだけ人生初めての失業を楽しもう。







ヨーグルトには、五穀などの穀物が入っていたり、サラダにもアワやヒエのような体に良さそうな穀物が入っていてエルシー。
2024/01/26 Mr.HARIKIRI
![[Kw] 転職サイト-お世話になってみた~転職サイト!多くないか? [2024/01/25~ 更新2024/03/30]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/04/B27FC01B-E7AE-4B3F-960A-EC6BA9631D88.png)
を受けるには「ハローワーク」で”転職活動”を1ヶ月以内に2回行う必要がある。そうでないと認定されない。認定日という日があってその日はハローワークに出向むく必要がある。認定されて1か月分の給付が頂けることになる。その前にまずは最初の手続きが必要ですね。
したら、前の会社から失業したことを証明する書類を受け取り、全国どこでもいいので「ハローワーク」に出向く。その日が申請日となる。
申請が完了したら、その日から7日間は仕事をしてはいけない。その7日後にハローワークに資格証明書をもらいに行く。この書類には給付番号が記載されている。その後、1時間程度の研修を受けて前述/後述したような給付を受けるためのルールを確認する。研修が済めば、折角来たのだから「就職活動」をしておこう。これを行えば、月に2回の活動ノルマの内、1回を確保できる。その後1ヶ月後までにもう一度「就職活動」をしにハローワークにこよう。
も利用しよう。2024/03現在,以下の12サイトに登録した。転職サイトはどんどん立ち上げられているようだ.そんなに活況なのか? もう何が良いか分からんが数を打った。リクルート〇〇の区別はもう分からない.登録していると増えたので経緯はもう忘れてしまった.
昨日(2024/03/29),関西における求人倍数の発表があった.大阪では1.0?倍,その他周辺の関西エリアの件では,1.2?倍とか求人する企業は比較的多いようだ.内訳では,製造業などは原材料などの投入コストが上がっているために,求人は控えている傾向がある.旅行などサービス業などでは活況のようだ.旅行客が増えているからだろう.僕はホテルを良く利用するが,そら価格がコロナ過以前に戻ってしまったので,なかなかリッチなホテルの利用が出来なくなってきた.ついでに,予約は直ぐに埋まってしまう.先日も,娘の誕生日に毎年,クリスマスにリッツカールトンを利用していたが,この9カ月前で空室が無くなっていた.
話っを戻して,
因みに「リクルートネクスト」はハイクラスではない求人を取り扱っているようだ.時給何円とかの記載が多い.
求人ボックスは,携帯電話のアプリから導入した.ニッチをついている求人があるように思った.
Pason Careerは,しょっぱなから2つに応募したが,マッチングしないとの理由で「見送られた」のでそれ以後は利用していない.そもそも,PWを忘れたためマイページにたどり着けなくなったので,PWの再設定をしようとしたが,PWの再設定には,メールアドレスの他にマイページIDも必要だった.マイページIDなど覚えていないし,先のメールにもの「見送られた」との情報はあるものの,マイページIDはどこにも記載がない.マイページIDはこの世から消えてしまったのである.もうPason Carrerは使えない.再登録しろってか.履歴の再入力はもういやだ (欅坂46, 不協和音をもじってみた).
それで,これまでにエントリーさせてもらったことがあるサイトだが,ビズリーチ,リクルートエイジェント,製薬オンライン,求人ボックスの4つ.ビズリーチに登録しているHH企業のJACや各サイトのHHさんにもお世話なっている.
とは、転職サイトが自らのスタッフがエイジェントも担う場合もある。また、エイジェント(ヘッドハンター)会社や個人のヘッドハンターが転職サイトに登録している。さらに、求人会社と、僕たちみたいな就職希望者が登録している。BizReachではプレミアムコースがあり、1ヶ月5,500円程度で求人の会社名などの開示やその他特典があるようだ。
ググってみると転職サイトには、医者専用、建設工事専用、薬剤師専用、僕が係る”抗体医薬”専用などが見つかる。
転職サイトで検索などや日々送られてくる求人情報をみて、応募するか決めるのだが、「リクルートエイジェント」では応募しないというボタンもある。これは必要な機能だろうなと感じる。おそらくAIが見繕っと送ってくるのだから、意思表示を明確にするのが今後のAIの動作として絞り込みに役立つのでは無いかと思う。
応募しても返事のない案件もあった。催促すべきか。それともそのような会社はこちらから相手にしない方が良いのか。色々と勉強になる。1年前に最初に登録した転職サイトでは、登録した当初、いきなり数件のヘッドハンターから連絡がありZoom面談をしたが、その内の1件は個人でヘッドハンターをしている方がいた。案件の紹介を受けたが、まだ転職には本格的に行う気がなかったので見送らさせてもらった。その後1年が経過して、転職する必要が出てきたため、転職サイトでのメール機能の履歴から連絡を取ってみたが、音沙汰がなかった。もう廃業されたのでしょうか?
あと、疑心暗鬼なのは、企業名が非公開となっている求人で、そもそもその求人はあるのかと思ってしまう。客寄せでは無いのかと。
求人サイトのCMには,転職は考えていなくても「自分の価値」をしるために登録するのもあり,と登録を誘っている.そのフレーズは,僕が昨年の1月にBiz〇に登録したての時に,いきなり3社のヘッドハンター(HH)がから声がかかって,僕自身がHHに対して登録の動機を説明した時のフレーズだった.でも,登録だけでは,何の価値もわからないことは,経験者として断言できる.その後の企業へのエントリー,すなわち「書類選考」をしてみないと,自分の価値は不明のままである.
「履歴書」・「職務経歴書」を何度も作り直して,やっとのことで「求人している企業」にエントリーをHH経由または,直接で行うとその「自分の価値」が結果として返ってくる.それで初めて,「自分の価値」が一つ分かるのである.これまでにまあ,容赦無く「ダメ」が返ってきた.へこむね~.
ダメが返ってきたらまた「履歴書」・「職務経歴書」を見直す.
面接までいっても,まぁー,「ダメ」が返ってくる.世の中そんなものか.と開き直るにはまだ早い.
日本の労働流動性が低いのは,再就職がけっこう大変だからだろう,ということを身をもって知っている最中だ.試用期間があるのだから,とりあえず採用してよ~と言いたくもなるが,黙る.
60歳を過ぎことも大きな要因の一つで,エントリーしたある〇〇加工建設からは,”長く活躍してくれる人”を希望しているとの理由で「ダメ」だった.日本の企業,ベンチャーも含むだが,60歳定年で再雇用は65歳までと就業規則になっているのが普通のようだ.シニアの労働流動性は著しく低い.曲りなりに65歳までは働かせることは企業としてはできるはずなのである.”長く活躍してくれる人”というのは,余り納得のいく説明ではないなぁ.
最近,少し戦略を変更した.エントリーして結果が返ってくるのが1週間程度,面接の日程を決めるのに1週間,面接して結果が返るまでが,また1週間,ナド等,なかなか進まない.当たり前か.本当か? これは現実である.1社でいい感じに進んでいると安心していると途中で「ダメ」が出た時には,落胆この上ないことになる.そうだ,数を打つことにした.それをするには毎日忙しくしていないとできない.毎日,求人を探し,履歴書も何度も見直し,熟慮してエントリーするこ会社を選定する.1週間に3件のエントリーは必要だろう.これで少しは忙しくなるし,へんなネガティブ思考も浮かびにくくなった.
先日,医薬のコンサルタントの募集を見たので,メールを出して面談させてもらった.1時間半の長きにわたり,色々とためになるお話を聞くことが出来た.先方は個人事業主を集めてプロジェクトにあたるというビジネスモデルであり,その個人事業主を募集しているのが分かった.首謀者である方は,問題なく「飯を食える」ようだが,その他の方々は,定年退職して食には困っていないが,元気だし専門知識を活かすために仕事があるときには声をかけてもらって仕事をしている,という仕事のスタイルであることを伺えた.このお話はなかなか参考になった.そのようなスタイルがあるだろうことは想像に易いが,実際のコンサルタントの方から伺えたことはラッキーだった.結局,還暦そこそこではまだ,このスタイルはやめておいた方がいいとの意見ともう少し就職活動をして就職し,もう少し経験をつんでから連絡をしてね,とのことだった.もうこれ以上の経験を積むことに意味があるのかどうか不明だが.積むに越したことはないか.
Biz〇やその他求人サイトには,HHやHHを抱える会社組織も登録している.もちろん,僕みたいな就職活動している個人も当然登録している.どの登録サイトが良のかはよく分からない.求人している会社は,どのサイトでも見かける.何カ月も同じ会社の求人が残っている.これって,この前「ダメ」を貰った会社だよね.冷やかしですか?.そんなことないはずと黙る.でもそんな会社いっぱいあるね.ある情報では,会社が登録すると年間札束1つから2つ要るらしい.登録はしててもいいけど,求人の必要がなくなったのなら削除してほしい.そうではないか,いつまでも希望する求人が見つかっていないのだな.理解した.
愚痴はいわないことにしたいが,だがしかし.でも.
あるお寺に行った時に掲示されていた偉人の言葉が身に染みた.
「努力する人は希望を語り,怠ける人は不満を語る」
この言葉も物事を言い当てている.だが,簡略化しすぎているのではないか? 中間に位置する人は,希望も語るし愚痴も吐く,よね^^)
では,履歴書などの登録が必要ない.氏名やメールアドレスなど一般的な登録のみだ.好みの企業が見つかったので,登録ボタンを押してみた.「え,履歴書の登録してない」のに企業へのエントリー完了とか一来る.しばらくすると,その企業さんの人事担当者さまから,「履歴書」を送ってくれとのメールが届いた.それに対して,履歴書と職務経歴書を送信して心が落ち着いた.「そうゆうシステムになってるのか」と.
の特徴は,求人している会社さんの口コミ情報が集められていて,それが閲覧可能になっていることがあげられる.
は,月給20~30などの求人記載がみられる.ハイクラスではないターゲット層のようだ.
の特徴は,有料会員であるプレミアム・クラスがあり1カ月5千円と消費税(?)で利用できる.HHと直接連絡を取れたり,企業名が見れたり ,敵機的に(実は良く把握していない,無料クラスでの利用期間が少ないため).
最近(2024/03/29),無料とプレミアムをプラチナというクラスに一本化するとの連絡が流れた.その理由は,ありていに言えば,利用数が増えたことで労働資本の投入が増加したためだ.トラフィックを減らしたいということだな.
僕は,もう2カ月目のプレミアムを利用している.
携帯用の専用アプリからマイ・ページに飛べるなど使い勝手はいい.
の特徴は,担当されているキャリアアドバイザーから定期的なメール通達がある.これは,「気になる」をチェックした企業の求人状況に関する内容で,「気になる」数と,「応募済み」数を知らせてくれたり,企業の提案もしてくれる.
ライン・アプリに友達登録すれば,ラインからマイ・ページに飛べるなど使い勝手はいい.
は,サイトがダウンしていたり,前述したようにPWの再設定が僕のミスだができないなど,レスキュー能力が低すぎるサイトなので,スポイルした.
と行きましょうか。ご縁。タイミングもあるからね。何だったかな「数打って天命を待つ」。
2024/01/25 Mr.Harikiri
2024/03/26 追記(登録サイトの追記,すこし活動記録)
2024/03/30 追記(一部の登録サイトの特徴)
![[BIOLOGICS] 「essentical QbD」の進め方からバイオ医薬品におけるプロセス開発(QTPP/ CQA/CPP/PPA/IPQA/PC/PPQ batchの位置づけも含めて),日本と米国との違い [2025/04/09]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2021/02/02EFCDFA-2F1F-4542-819B-78B1FA05C140.jpeg)
世界で初めてバイオ医薬品が承認されたのは1982年,ヒト・インスリンは組換え大腸菌を生産細胞として,培養プロセスで生産され精製プロセスで医薬品にされたものである.以後,酵母や動物細胞,昆虫細胞を用いた生産系も現れた.いずれの場合でも,安全性と有効性の観点から品質を保証できるかが重要なポイントであるが,メーカー側視点では「生産性」の高さも経済性の観点から重要なポイントである.
「Essential QbD」は、ICHのガイドラインにおける正式な用語ではなく、実務や教育の現場、特に製薬業界において「QbDの本質的な要素や最低限必要な実装項目」を強調するために使われる概念的な表現である。
具体的には,フルスケールのQbDを全て実装するのはリソースが相当必要となるが,まずは,「Essential QbD」だけでも実施することで、申請・規制対応に十分な信頼性を確保することを目的としている.
PPQ(Process Performance Qualification)製造とPV(Process Validation)製造の違い、およびその日本と米国での取扱いの違いについて、以下にわかりやすくまとめます。
PPQとPVは日米で「定義・タイミング・承認との関係」において違いがある.
基本用語の整理
| 用語 | 意味 | 米国での使われ方 | 日本での使われ方 |
|---|---|---|---|
| PV(Process Validation) | プロセスが一貫して品質製品を生み出せることを示す全体活動 | ライフサイクル全体(Stage 1~3) | バリデーション実施そのものを指す(狭義) |
| PPQ(Process Performance Qualification) | 商業製造規模での実製造による性能確認(PV Stage 2) | FDAではPVの一部として位置づけ | 「日本では”PVの本体”」として扱われることが多い |
FDAの2011年 Process Validation ガイダンスでは、PVを以下の3ステージに分けられており製品ライフ策要るを示すものとなっている:
| ステージ | 内容 | PPQとの関係 |
|---|---|---|
| Stage 1 | プロセス設計 | QbD・CPP・CQAの設定 |
| Stage 2 | PPQ製造(Process Qualification) | 実製造スケールでの検証:**「PPQバッチ」**が該当 |
| Stage 3 | 継続的プロセス検証(CPV) | 市販後のモニタリングと改善 |
➡ 米国ではPPQはPVの一部であり、「Stage 2のアクション」
| 活動 | 内容 | タイミング |
|---|---|---|
| PV(=PPQ) | 承認申請における最終的な製造プロセス検証 | 原則として承認申請前に完了が必要 |
| GMP適合性調査 | PVの実施結果や施設を確認する | 審査と並行、もしくは審査後に実施される |
| 商業製造 | PVが完了してから開始 | 原則:PPQ完了→承認→市販製造の順番 |
特徴(日本):
比較:PPQ製造・PVのタイミングと扱い
| 観点 | 🇺🇸 米国(FDA) | 🇯🇵 日本(PMDA) |
|---|---|---|
| PVの定義 | ライフサイクル全体(Stage 1~3) | 狭義のバリデーション(実バッチ) |
| PPQの位置づけ | Stage 2の一部、PV中の確認工程 | PVとほぼ同義(実施=バリデーション) |
| PPQ製造のタイミング | 原則、承認前でもよい(要計画提出) | 承認申請時点で完了が望ましい |
| PPQバッチ数 | 通常2–3バッチ(統計的根拠に応じて調整) | 実務上は3バッチが多い(明文化なし) |
| 承認との関係 | 承認後に実施可能な場合も | 承認前に完了が原則(GMP適合性調査対象) |
| 柔軟性 | 高い(設計空間、パラメトリックリリースなど) | やや保守的、事前相談が重要 |
| ポイント | 米国(FDA) | 日本(PMDA) |
|---|---|---|
| PPQ製造のタイミング | 承認前でも、承認後実施もあり得る | 原則承認申請前に完了が必要 |
| PVの定義 | ライフサイクル全体 | 狭義の製造検証に集中 |
| 運用柔軟性 | 高い(計画+事後報告可) | 保守的(申請資料で完結が基本) |
日本の「従来型開発(実験中心)」と、「QbD(Quality by Design)アプローチ」には、開発の目的・手法・考え方**において本質的な違いがあります。
ここでは両者の違いを、比較表+具体例+背景の考察でわかりやすく整理します。
1. 全体的な比較(従来型 vs QbD)
| 観点 | 従来型開発(実験中心) | QbDアプローチ |
|---|---|---|
| 開発の目的 | 承認に必要なデータを集めること | プロセスと製品を科学的に理解・制御すること |
| プロセスの捉え方 | 「ブラックボックス」的に操作条件を決定 | 原材料・工程パラメータの因果関係を理解・モデル化 |
| 変更管理 | 条件変更は申請対応・再試験が必要になりやすい | 設計空間内の変更は申請不要(柔軟対応可能) |
| リスク評価 | 経験則や既知知識に依存 | FMEAやQRM(ICH Q9)に基づく定量的評価 |
| 実験の使い方 | 試行錯誤・経験ベース | DoE(実験計画法)など体系的手法を使って因果関係を解明 |
| 管理戦略 | 工程試験や最終試験で品質確保 | Control Strategy(CPP/IPQA/CPA)で予測的に品質を保証 |
| 文書の構造 | 結果中心の記述(試験値) | 設計意図・根拠・因果関係の記述が中心(科学的ストーリー) |
2. 具体例で比較:打錠製剤の溶出プロファイルを開発する場合
3. プロセス開発の日本での傾向と背景
| 項目 | 内容 |
|---|---|
| 実情 | 日本では依然として「従来型開発」が多数(特に後発品・一般製剤) |
| 導入の壁 | DoE・統計解析に慣れていない、QRMの文化が浅い、リソース・時間的制約 |
| 導入が進む分野 | バイオ医薬品、新薬、大手製薬企業のグローバルプロジェクトなどではQbD導入が増加中 |
| PMDAの姿勢 | QbDは義務ではないが、「導入すれば科学的妥当性がより明確に説明できる」として評価対象に含む方針 |
4. プロセス開発における実務対応のポイント
| 開発フェーズ | 対応の違い(従来型 vs QbD) |
|---|---|
| CQAの設定 | 経験+ガイドライン参照 vs. リスク評価+QTPPからの論理導出 |
| プロセス条件決定 | 実験→判断→再実験の繰り返し vs. DoEで効率的に条件最適化 |
| 製造変更 | 結果を確認して対応 vs. 事前に設計空間内で柔軟対応可能 |
| CTDの書き方 | 試験結果中心の記述 vs. 理由や因果関係に基づく記述が増える |
まとめ:プロセス開発における従来型とQbD開発の違い
| 目的 | アプローチ | メリット | デメリット |
|---|---|---|---|
| 従来型 | 実験→結果→最適条件 | 短期対応に強い | 再現性や変更対応に弱い |
| QbD | 科学的理解→設計→管理 | 再現性、変更耐性、申請柔軟性 | 導入に時間・教育が必要 |
以上,日米でQbDの位置づけ,プロセス開発におけるPPQ,PVの定義の違いがあることから,以下のEssential QbDに関する解説では,日本の場合に必ずしも当てはまらない記載があることを認識しながら理解を進めてほしい.
Essential QbDとは、「QbDの核となる最低限の構成要素」を実装した状態であり、バイオ医薬品開発における規制対応・リスク最小化・品質保証の基盤となる概念である。
| 要素 | 内容 |
|---|---|
| QTPP(Quality Target Product Profile) | 患者にとって望ましい製品特性。品質の目標となるもの。 |
| CQA(Critical Quality Attributes) | 製品の品質に重大な影響を与える特性(純度、無菌性など)。CTD Module 3関連 |
| CPP(Critical Process Parameters) | CQAに影響を与えるプロセスパラメータ。CTD Module 3関連 |
| Risk Assessment(品質リスク評価) | CQAやCPPの関係性を明らかにするための手法(例:FMEA)。 |
| Control Strategy(管理戦略) | 安定した製造を確保するための設計空間や制御方法。 |
これらは、ICH Q8(R2)、Q9、Q10、Q11などのガイドラインで示された原則の中核的なものです。
CMC(製造管理・品質管理)パートの説得力を高める
ICHの柔軟性ある承認制度(Design Spaceの活用など)につながる
結論:
QTPP(品質目標製品プロファイル)
CQA(重要品質特性)
CPP(重要工程パラメータ)
リスクアセスメント
Control Strategy(管理戦略)
これらは Essential QbD の「基本構成要素」としては妥当であり、最低限の核としては十分 とみなされます。
👉 ただし、実務や規制要件の観点からは、以下の補完的要素がしばしば組み込まれます。
補完的なQbD構成要素(必要に応じて)
| 要素 | 解説 | なぜ重要? |
|---|---|---|
| Design Space(設計空間) | 科学的根拠に基づき、品質を損なわない範囲を設定 | 柔軟な製造変更・規制対応が可能に |
| DoE(Design of Experiments) | 実験計画法によりパラメータと品質の関係性を可視化 | CPP/CQAの決定に使う主要ツール |
| Process Understanding(プロセス理解) | メカニズムや変動要因の理解 | 科学的根拠に基づくControl Strategyの基礎 |
| PAT(Process Analytical Technology) | 製造中にリアルタイムで品質を測定・制御する技術 | 継続的なプロセス制御とCPVに寄与 |
| Lifecycle Approach(継続的改善) | PVステージ3や製品ライフサイクル全体での制御 | QbDは一度限りでなく、継続的な活動 |
FDAやICHの視点では?
| ガイドライン | QbD要素の扱い |
|---|---|
| ICH Q8(R2) | QTPP, CQA, CPP, Control Strategy, Design Space, Risk Assessment を中核要素と明言 |
| FDA PV Guidance | QbDの一貫としてライフサイクルとCPVを重視 |
| ICH Q9 (QRM) | リスク評価をQbDに不可欠と位置付け |
| ICH Q10 (PQS) | 継続的改善を通じた品質システムとの統合を推奨 |
結論まとめ
| 質問 | 回答 |
|---|---|
| あなたの挙げた5要素はEssential QbDとして最低限足りるか? | ✅ Yes(基本構成としてはOK) |
| 実務的・規制的には他の要素も必要? | ⚠️ Yes(Design Space、DoE、PATなども加わることが多い) |
前提と目的を以下に示す.これは,バイオ医薬品におけるプロセス開発の最低限の活動でもある.
手順を以下に示す.
FDAの「Process Validation: General Principles and Practices」(2011年発行、CDER/CBER共通)によれば:
**「Process Validationとは、製造プロセスが一貫して所定の仕様と品質特性を満たす製品を産出できることを、科学的根拠とデータに基づいて示すこと」**です。
これは3つのステージで構成される.
Stage 1 ステップで行うべき活動
| ステップ | 活動内容 | 説明 |
|---|---|---|
| ① QTPPの設定 | 製品の品質目標プロファイルを定義 | 安全性、有効性、剤形の要件など |
| ② CQAの特定 | 品質に影響する特性を明確化 | 含量、純度、溶出、安定性など |
| ③ リスク評価 | 原料、設備、工程の影響を評価 | FMEA、Ishikawa、PRAなど使用 |
| ④ CPPの抽出 | CQAに影響する重要工程パラメータの特定 | 温度、時間、撹拌速度など |
| ⑤ IPQAの選定 | 工程中でリアルタイムに監視すべき品質属性 | 中間体のpH、粒度、含量など |
| ⑥ PPAの選定 | プロセスのパフォーマンスを表す指標 | 発現量、回収率、粘度、操作負荷など |
| ⑦ DoEの実施 | CPP・PPA・CQA間の関係を解析 | 設計空間や制御限界の基礎 |
| ⑧ 初期Control Strategy設計 | 上記パラメータの管理方法策定 | 管理点、モニタリング、許容範囲など |
| ⑨ スケールアップ/技術移管検討 | Pilotから商業製造への移行設計 | 装置適合性、タイムライン整合など |
PPAの実例(バイオ医薬品)
| 工程 | PPA例 | 説明 |
|---|---|---|
| 細胞培養 | 抗体発現量、培地消費速度 | 生産性と培養健全性の指標 |
| 精製 | 回収率、圧損、導電率プロファイル | 操作の安定性を表す |
| 製剤 | 粘度、ろ過時間 | 製造負荷や均一性のトレンド指標 |
まとめ
| 観点 | IPQA | PPA |
|---|---|---|
| CQAとの関連 | 中程度~強い | 弱いこともあるが重要な間接指標 |
| Stage 1での必要性 | ✅ 必須 | ✅ 含むべき |
| Stage 3(CPV)との関連 | ✅ 直接対象 | ✅ 重要なモニタリング指標 |
結論
Stage 1において、PPAの選定は必須ではないが、QbDおよびCPVの観点からは含めるべき活動である。
IPQA, PPAの評価方法 :
IPQAやPPAを「Critical/Key/Non-key」に分類する基準は、リスクベースの考え方(主にCQAへの影響度やプロセス性能との関係)に基づいて判断されます。以下に、培養工程と精製工程における具体的な例と評価基準を示します。
| 区分 | 定義 | 判断基準(例) |
|---|---|---|
| Critical | CQAに直接的・重大な影響を与える | 逸脱で品質・安全性に重大影響 |
| Key | プロセス性能や一部のCQAに影響あり | モニタリング・制御が望ましい |
| Non-key | 品質に与える影響が軽微・なし | 管理対象ではあるが重要度は低い |
👉 この分類は、FMEA(Failure Mode and Effects Analysis)やリスクマトリクスを用いて科学的に決定するのが望ましいです。
例①:培養工程における IPQA / PPA の分類例
| 属性 | タイプ | 区分 | 理由(評価ポイント) |
|---|---|---|---|
| 培養液のpH | IPQA | Critical | 酵素活性や細胞代謝に影響、糖鎖構造・CQAに影響あり |
| 温度 | IPQA | Critical | タンパク発現・折りたたみ・不純物プロファイルに影響 |
| 撹拌速度 | PPA | Key | 酸素供給やせん断による細胞生存率に間接影響 |
| pCO₂レベル | PPA | Key〜Non-key(ケース依存) | 細胞種や培地によって影響が変わるため再評価必要 |
| 発泡の有無 | PPA | Non-key | 多くのケースでは製品品質に直接影響しない(ただし運転に支障ならKey) |
| 抗体発現量(生産量) | PPA | Key | 製品歩留まりには重要だがCQAには直接影響しない場合も多い |
💧 例②:精製工程における IPQA / PPA の分類例
| 属性 | タイプ | 区分 | 理由(評価ポイント) |
|---|---|---|---|
| Protein A残留量 | IPQA | Critical | 安全性・免疫原性に直結するCQA |
| 回収率 | PPA | Key | 歩留まり・コストに重要だが、品質特性には間接的 |
| クロマトグラフィーのpH | IPQA | Critical | 結合・溶出に影響し、純度や変性体生成に影響 |
| カラム圧力 | PPA | Key | 装置トラブル予兆にはなるがCQAとはやや遠い |
| 濾過時間 | PPA | Non-key | 作業性には関係あるが、製品品質には無関係の場合が多い |
| 濾過後の濁度 | IPQA | Key(製品によってはCritical) | 微粒子残留や清澄性に関連。注射剤ならより重要 |
判断のヒント(どちらに分類するか悩んだとき):
| 評価観点 | 質問例 |
|---|---|
| 品質への影響度 | 属性が逸脱したら製品のCQAが変化するか?(Yes → Critical) |
| リスクの検出性 | 異常時にすぐ検出・補正できるか?(No → Criticalに近づく) |
| 頻度と変動性 | 工程でよく起きる変動か?(Yes → Key以上で検討) |
| 安全性・有効性との関連 | 最終的に患者リスクに結びつくか?(Yes → Criticalの可能性大) |
書式化のサンプル(表形式で管理されることが多い)
| 属性名 | 工程 | タイプ | 区分 | 管理方法 | 備考 |
|---|---|---|---|---|---|
| 培養温度 | 培養 | IPQA | Critical | 連続モニタリング+逸脱制御 | 設定範囲外ではCQA変動 |
| 発現量 | 培養 | PPA | Key | 定期確認 | 歩留まりトレンド確認用 |
| 回収率 | 精製 | PPA | Key | 各バッチ記録 | 生産性KPI。CQAとは独立 |
| カラムpH | 精製 | IPQA | Critical | 設定条件+検証 | 結合効率に強く影響 |
まとめ表
| 要素 | IPQA | PPA |
|---|---|---|
| 主な役割 | 中間工程での品質確保指標 | プロセス性能・健全性の指標 |
| Criticalになりやすい? | はい(CQAと近い) | 一部(例:糖鎖分布に影響する場合など) |
| Keyになりやすい? | 多くのIPQA | 多くのPPA |
| Non-keyの例 | 発泡量、濾過時間(製品依存) | 装置条件に関する操作性パラメータなど |
QTPPとは?
最終製品に求められる品質属性の目標プロファイル
ICH Q8(R2)やFDAガイダンスにおいて、製品設計・開発・プロセス設計の出発点として位置づけられています。
QTPPはどう使われるの?
【バイオ医薬品(例:モノクローナル抗体製剤)】のQTPPの例
| 要素カテゴリ | QTPPの具体例 | 説明・目的 |
|---|---|---|
| 投与経路 | 静脈内注射(IV) | 生物学的利用能と投与設計に直結 |
| 投与量・用量強度 | 100 mg/vial(バイアル) | 治療効果と用量設計 |
| 投与スケジュール | 2週間に1回 | 投与負担と治療継続性に関係 |
| 製剤形態 | 凍結乾燥品、注射用溶解液付き | 安定性と使用利便性 |
| 有効期間(Shelf-life) | 24か月(冷蔵保存2~8°C) | 安定性、保管・流通管理 |
| 安定性指標 | 凝集率 < 2%、pH 6.0±0.2 | 物理・化学的安定性の担保 |
| 無菌性 | USP <71>に適合(無菌性試験) | 微生物汚染防止の必須条件 |
| 生物活性 | 基準活性値の±20%以内 | 薬効を保証する指標 |
CQAとは:
最終製品または中間体の品質にとって「重大な影響を与える可能性のある属性(特性)」であり、その仕様・制御が必要とされるもの。
FDAやICHでは次のように定義されています:
「CQAとは、製品の安全性および有効性に影響を及ぼす可能性がある物理的、化学的、生物学的、または微生物学的特性や特性値」
(ICH Q8(R2)より)
CQAはどう選ばれるのか?
関連ガイドライン
CPPとは?
「製品の品質(CQA)に重大な影響を与える製造プロセス上のパラメータ(操作条件)」のこと。
FDAやICHでは次のように定義されています:
CPPとは、製品のCQAに影響を及ぼす工程パラメータであり、適切に制御されなければ製品品質に逸脱を生じさせる可能性があるもの。
CPPの基本的な特徴
CPPの具体例(製品・工程別)バイオ医薬品(例:抗体製造)
| 工程 | CPPの例 | 関連するCQAへの影響 |
|---|---|---|
| 培養工程 | 温度、pH、溶存酸素(DO)、撹拌速度、培地の供給速度 | 糖鎖構造、凝集体生成、活性の変化 |
| 精製工程 | クロマトグラフィーの流速、バッファーpH、塩濃度 | 純度、不純物プロファイル、回収率 |
| 製剤工程 | ろ過圧力、混合速度、最終pH調整 | 安定性、粒子形成、pH維持 |
CPPの特定方法
CPPは以下のようなプロセスを経て特定されます:
関連するガイドライン
まとめ
CPPとは「CQAに影響を与える工程パラメータ」であり、QbDとバリデーションにおいて「何をどのように制御すべきか」を決める中心的な概念です。
適切なCPPの設定と制御によって、製品の品質は**工程から保証される(Quality is built into the process)**というQbDの基本理念が実現されます。
IPQAとは?
「製造工程中に測定・監視される品質関連の特性であり、製品品質(CQA)を確保するための制御指標として活用されるもの」
IPQAの具体例
バイオ医薬品(例:抗体製剤)
| 工程 | IPQAの例 | 関連するCQA(例) |
|---|---|---|
| 培養(上流工程) | 細胞密度(VCD) 比活性 グルコース/乳酸濃度 溶存酸素(DO) pH | 糖鎖プロファイル、凝集体、純度、生物活性 |
| 精製(下流工程) | クロマト溶出ピーク特性 pH 導電率 収率 | 純度、残留不純物、安定性 |
| 製剤化 | 濃度均一性 pH タンパク質含量 ろ過流速 | 含量、安定性、無菌性 |
IPQAとCQA/CPPとの関係
例:
CPP(pH)→ IPQA(細胞密度)→ CQA(糖鎖構造)
IPQAの役割
| 項目 | 内容 |
|---|---|
| 工程制御 | 工程中にモニター・制御して製品品質を担保 |
| 逸脱管理 | 異常傾向の早期発見、逸脱調査の根拠 |
| PATの活用対象 | リアルタイム測定可能な指標(例:NIRで含量) |
| PPQ・CPVでの重要指標 | 工程能力や再現性の評価項目に含まれる |
ICHやFDAでの位置づけ
まとめ
IPQAとは、工程中にモニタリングされる品質関連の特性であり、製品のCQAを確保するための早期制御・予測指標として極めて重要な役割を担います。
PPAとは?
プロセスが一貫して安定かつ期待通りに機能していることを示すパラメータや指標のこと。
PPAの定義と特徴まとめ
| 観点 | 説明 |
|---|---|
| 定義 | プロセス性能(ばらつき、収率、操作安定性など)を定量化する指標 |
| 主目的 | 工程の再現性・安定性を評価すること(「工程が制御下にある」状態の確認) |
| 測定対象 | CQAやIPQAと異なり、「工程動作」や「出力結果(収率など)」に関するパラメータ |
| 関連性 | 多くの場合、CQAに間接的な影響を与える可能性がある(=リスク評価対象) |
PPAの具体例(工程別)
バイオ医薬品(例:抗体製造)
| 工程 | PPAの例 | 目的・意味 |
|---|---|---|
| 培養 | 撹拌速度、ガス流量、収率、培養時間 | 操作一貫性や最終タンパク質量の評価 |
| 精製 | 回収率、ろ過流速、クロマト圧力 | 操作条件の安定性や効率のモニタリング |
| 製剤 | フィルター差圧、ブレンド時間 | 最終製剤品質に向けた工程制御 |
PPAと他の属性との違い
| 区分 | 属性名 | 内容 | 測定目的 |
|---|---|---|---|
| 製品品質属性 | CQA | 製品品質に直接影響する属性 | 規格適合性の保証 |
| 工程中品質属性 | IPQA | 工程中に品質に関係する指標 | 中間製品の制御、逸脱検知 |
| 工程性能属性 | PPA | 工程の安定性・再現性を表す指標 | 工程そのものの健全性評価 |
PPAの評価方法
PPAの活用場面
| 活用シーン | 内容 |
|---|---|
| PPQ(工程適格性評価) | 工程が一貫して再現できているかを示す指標 |
| CPV(継続的工程確認) | 商用製造における安定性トレンドのモニタリング対象 |
| 変更管理や工程改善 | 異常値や傾向変化から改善の必要性を判断 |
規制の観点から
まとめ
PPA(Process Performance Attribute)とは、製造工程が安定かつ再現性をもって機能しているかを評価するための重要な属性です。
製品品質に直接影響しないこともありますが、工程そのものの「健全性」を測る上で不可欠です。
PPA ⊆ PAであり,PPAは工程に関する場合,PAは品質に関する場合に使われることがおおい.
🔸 PPA(Process Performance Attribute)
→ プロセスの健全性・一貫性・能力を示す属性
🔹 PA(Performance Attribute)
→ より広義な概念で、PPAを含むこともあれば、製品性能に関わる指標を指す場合もある。
👉 PPA ⊆ PA として扱われることが多いです。
でも、企業や文脈によって「ほぼ同義」として使っているケースも見られます。
定義と違い(整理)
| 項目 | PPA(Process Performance Attribute) | PA(Performance Attribute) |
|---|---|---|
| 対象 | 製造プロセスに特化 | プロセス+製品性能含む場合も |
| 目的 | 工程の能力・安定性を評価 | 性能全般(製品品質との関連含む) |
| 例 | 生産量、培養pH、精製回収率 | 凝集率、粒度分布、溶出速度 |
| 管理対象 | 通常はCPVでモニタリング | 品質設計や制御の指標にもなる |
実務的な使用例(バイオ製剤)
| 属性 | PPA? | PA? | 説明 |
|---|---|---|---|
| 抗体の発現量 | ✅ | ✅ | 工程能力を示す(PPA)、品質との関連も(PA) |
| 細胞の生存率 | ✅ | ⬜️ | 工程制御には重要だが、製品性能には間接的 |
| 蛋白凝集率 | ⬜️ | ✅ | 最終製品の安定性や免疫原性に直結(PA) |
| pH(培養中) | ✅ | (状況による) | 工程中のCPPに近く、パフォーマンス指標にも使われる |
備考:用語のブレに注意
まとめ
| 視点 | PPA | PA |
|---|---|---|
| 工程中心 | ✅ | △ |
| 製品中心 | △ | ✅ |
| ほぼ同義に扱われる? | 一部企業や実務ではYes | ただし厳密には違いあり |
Material Attributes(MA)とは?
Material Attributes(原材料特性)とは、製造に使用される原料・中間体・補助材料などの物理的・化学的・生物学的特性であり、製造プロセスや製品の品質(CQA)に影響を与える可能性があるものです。
ICH Q8(R2)やFDAのQbD関連ガイドラインにおいても、重要なプロセス入力(Input)として明示されています。
代表的なMaterial Attributesの対象
| 材料の種類 | 例 |
|---|---|
| 原薬(API) | 結晶多形、粒径分布、比表面積、含水率 |
| 賦形剤(Excipients) | 粘性、pH、粒度、水分含量 |
| バイオ医薬品の培地成分 | グルコース濃度、アミノ酸濃度、原材料由来の不純物 |
| プロセスバッファー | pH、イオン強度、導電率 |
| 包装材 | 材質、透湿性、抽出物・溶出物(E&L)特性 |
なぜ重要か?
Material Attributes はプロセス入力であり、下記のように製造プロセスや最終製品に影響します:
関連する分類:CMA(Critical Material Attributes)
CMA(重要原材料特性):CQAに影響する可能性があると判断されたMaterial Attribute
CQAとの因果関係が強いMAは、**CMA(Critical Material Attribute)**として制御対象となり、管理戦略(Control Strategy)に組み込まれます。
実務での評価方法
| 手法 | 内容 |
|---|---|
| リスクアセスメント(例:FMEA) | MAがCPPやCQAに与える影響を定量評価 |
| DoE(実験計画法) | 原材料ロット差・スペック差を工程や製品品質と照合 |
| 受入試験・規格設定 | 変動許容範囲を設定し、スペック外ロットを排除 |
ICH Q8/Q11での記載
まとめ
Material Attributes(MA)とは、製造に用いるすべての材料の性質であり、その変動がプロセスや製品品質に影響を与える可能性がある。
特にCQAに影響がある場合は「Critical Material Attribute(CMA)」として識別・制御が必要です。
Control Strategy(管理戦略)とは?
定義(ICH Q8より)
“A planned set of controls, derived from current product and process understanding, that ensures process performance and product quality.”
つまり:
Control StrategyとFDA PVアプローチの関係
FDAのPVガイダンスではプロセスバリデーションを3ステージに分けています:
| ステージ | 内容 | Control Strategyとの関係 |
|---|---|---|
| Stage 1 | プロセス設計 | 管理戦略の基礎構築(CPP、CQAの設定) |
| Stage 2 | プロセス適格性評価(PPQ) | コントロール戦略が機能するか検証 |
| Stage 3 | 継続的プロセス検証(CPV) | コントロール戦略の有効性をモニタリング&継続的改善 |
Control Strategyの構成要素(例)
| カテゴリ | 具体例 |
|---|---|
| 原材料管理 | APIや賦形剤の受入規格、供給元管理 |
| 設備・装置の管理 | 校正、メンテナンス、適格性評価 |
| プロセスパラメータの管理 | 例:撹拌速度、温度、pHなどのCPP |
| インプロセス試験(IPC) | 製造中の中間体のCQAチェック |
| 最終製品試験 | 製品の品質特性(含量、純度、溶出など) |
| PAT(Process Analytical Technology) | リアルタイムでの品質評価手法 |
| ソフトウェアによるモニタリング | データ収集、SPC、逸脱検知など |
| CTDモジュール | セクション | 内容 |
|---|---|---|
| Module 3.2.S | S.2.4(Control of Critical Steps and Intermediates) | 原薬バルク工程のCPP、IPQA、工程制御の記述 |
| Module 3.2.P | P.3.3(Description of Manufacturing Process and Process Controls) | 製剤工程のCPP、IPQA、CPAの制御方法の記述 |
| Module 3.2.P | P.2(Pharmaceutical Development) | Control Strategyの開発的背景や構築根拠(QTPP、CQA、DoE、リスク評価など) |
| Module 3.2.R | (Regional Information) | 全体のControl Strategyをまとめた図表・補足資料(必要に応じて) |
各セクションでのControl Strategyの記載内容
🔹 3.2.P.2 – Pharmaceutical Development
👉 QbDアプローチをとっている場合、このセクションが非常に重要になります。
🔹 3.2.P.3.3 – Manufacturing Process and Process Controls
👉 「Control Strategyの実行内容」を具体的に記述する場です。
🔹 3.2.S.2.4 – Control of Critical Steps and Intermediates
🔹 3.2.R – Regional Information
Control Strategy記載イメージ(例:表形式)
| 製造工程 | 管理対象 | パラメータ | 管理手法 | 重要度 | 関連CQA |
|---|---|---|---|---|---|
| 混合工程 | 撹拌速度 | 200–400 rpm | 自動制御 + IPC | CPP | 均一性 |
| 濾過工程 | 濁度 | <1 NTU | IPC + 視認 | CPA | 微粒子含有量 |
| 凍結乾燥 | 凍結速度 | –0.8 °C/min | 設備制御 | CPP | 安定性 |
まとめ:Control Strategyをどこに書くか?
| セクション | 目的 | 記載内容の例 |
|---|---|---|
| 3.2.P.2 | 開発の根拠 | QTPP → CQA → CPP/CPA、DoE、リスク評価 |
| 3.2.P.3.3 | 実務上の制御内容 | 各工程でのパラメータ制御、許容範囲、モニタリング |
| 3.2.S.2.4 | 原薬プロセスの制御 | 精製・濃縮・凍結などのCPP管理 |
| 3.2.R(任意) | 補足資料としてまとめ記載 | Control Strategyのサマリー表や図解 |
バイオ医薬品の製造は大きく 上流(Upstream)、下流(Downstream)、製剤化(Drug Product) に分かれ、それぞれに管理戦略があります。
【上流工程:細胞培養】
| 項目 | 管理内容 | CQA/CPPとの関係 |
|---|---|---|
| セルバンク | マスター&ワーキングセルバンクの特性・保管・管理 | 製品一貫性に影響(CQA) |
| 培地組成 | 原料のロット管理、品質試験、添加時点の制御 | タンパク質発現や修飾に影響 |
| 培養条件 | 温度、pH、DO、撹拌、栄養補給のタイミング(CPP) | 生産量や品質特性に影響 |
| 発酵時間 | 最適な採取タイミングの設定 | 分解生成物や変異のリスク管理 |
【下流工程:精製】
| 工程 | 管理内容 | CQAとの関連 |
|---|---|---|
| プロテインAクロマトグラフィー | 結合・溶出条件の管理、リーク量管理 | 抗体純度(CQA) |
| イオン交換クロマト | pH・導電率の調整、分離プロファイル管理 | チャージバリアントの調整 |
| UF/DF(超濾過/限外濾過) | バッファ交換・濃縮条件の管理 | 安定性や凝集性に影響 |
| バイオバーデン/エンドトキシン管理 | 精製後の無菌性維持 | 安全性(CQA) |
【製剤工程(Drug Product)】
| 項目 | 管理内容 | 対象とするCQA |
|---|---|---|
| 賦形剤の種類・濃度 | 安定性、pH緩衝、タンパク質保護 | 安定性、凝集リスク |
| ろ過滅菌 | フィルターのバリデーション | 微生物汚染リスク |
| 充填量・容器選定 | 溶出物、吸着、適正な用量 | 安定性と投与安全性 |
| 凍結乾燥条件(該当時) | 凍結速度、真空圧、乾燥時間 | 活性保持、再溶解性 |
モニタリングとCPVとの関係
Control Strategy は 一度設計して終わりではなく、製造後も継続的にモニタリング(=CPV)されます。
書類としての位置付け(CTD例)
| 書類 | Control Strategyに関する内容 |
|---|---|
| 3.2.S / 3.2.P(CMC) | 製造方法、CPP・CQAの管理内容 |
| 3.2.R(Regional) | Control Strategy全体を図表でまとめることも |
| 3.2.A(設備) | コントロールを支える設備の管理 |
補足:Control Strategyをサポートするツール
Process Analytical Technology(PAT)
Design of Experiments(DoE)
Quality Risk Management(QRM)
Design Space(設計空間)
| 要素名 | 意味・定義 | 主な役割 | 関連ステージ |
|---|---|---|---|
| QTPP (Quality Target Product Profile) | 最終製品に求められる品質特性(例:効能、安全性、安定性) | 製品設計とプロセス設計の出発点。CQAの設定に影響。 | Stage 1、Stage 2、Stage 3 |
| CQA (Critical Quality Attribute) | 製品の品質に重大な影響を与える属性(例:純度、無菌性、活性) | プロセスが制御されているかどうかの最終評価指標 | 全ステージ |
| CPP (Critical Process Parameter) | CQAに影響を与える重要な工程パラメータ | CQAを確実に得るための制御対象として設計・監視 | Stage 1、Stage 2、Stage 3 |
| IPQA (In-Process Quality Attribute) | 製造中にモニターされる品質指標(例:細胞密度、比活性) | 工程制御や中間製品品質の確認に使用 | Stage 1、Stage 2、Stage 3 |
| PPA (Process Performance Attribute) | プロセス性能の評価指標(例:収率、撹拌効率、工程時間) | 工程の再現性・安定性の監視に用いられる | Stage 1、Stage 2、Stage 3 |
| Material Attributes(MA) | 原材料の特性(例:培地成分、粒径、水分など) | プロセス変動やCQAへの影響因子として評価・管理 | 主にStage 1(設計)、Stage 3での評価も重要 |
| CMA (Critical Material Attributes) | 原材料の特性で、プロセスやCQAに影響を与える | 品質変動要因の抑制と原材料管理に | Stage 1, 2, 3 |
| Control Strategy | CQAを保証するための包括的な制御手段(パラメータ、試験、モニタリング) | プロセス全体の制御・管理の枠組み。文書化され当局に提出される | Stage 1(設計)、Stage 2(検証)、Stage 3(実行・見直し) |
| Risk Assessment | リスクの識別・評価・管理手法(例:FMEA、Ishikawaなど) | 属性や因子の優先度付けと制御範囲の根拠に活用 | 特にStage 1(設計)、見直しは全ステージ |
| Design Space | 科学的に証明された操作範囲(CPPの組合せ) | 柔軟な製造運用を可能にする承認済の変動範囲 | 主にStage 1で提案・設計、Stage 2以降で適用可能 |
| PAT (Process Analytical Technology) | プロセス中でのリアルタイムな分析・制御技術 | CPV・制御戦略の一部として活用される | Stage 2(活用)、Stage 3(監視) |
| Continual Improvement | 継続的な品質改善活動 | CPVなどを通じて工程の最適化・見直しに活用 | 主にStage 3、品質システムの一部として |
| CPV (Continued Process Verification) | 継続的プロセス検証 | プロセス状態維持,逸脱・トレンド早期発見,CAPAトリガー | Stage 3 |
QTPP
└─> CQA
├─> CPP
├─> IPQA
└─> 関連する PPA
↑ ↑
│ └─ Control Strategy
│
├─ Material Attributes(入力変動要因)
│
├─ Risk Assessment(全体設計の分析手法)
├─ Design Space(科学的操作範囲)
├─ PAT(リアルタイム監視)
└─ Continual Improvement(運用・見直し)
| 要素 | 重要度ランク分類の目的 |
|---|---|
| CQA | 最終製品の品質に与える影響に基づき「Critical / Non-Critical」などに分類(非公式にKey/Non-Keyとする例も) |
| CPP | プロセス変動がCQAに影響する度合いで「Critical / Key / Non-Key」に分類し、制御戦略を立案 |
| IPQA | CQAとの相関や工程中での制御価値に基づいて「Critical / Key / Non-Key」分類(PAT対応など含む) |
| PPA | 工程の性能とCQAへの影響可能性に基づいて分類(前述) |
| 原材料特性(Material Attributes) | 変動がCQAやCPPに影響するかどうかで「Critical Material Attribute(CMA)」などに分類 |
| 分類カテゴリ | よく使われる用語(例) |
|---|---|
| 高リスク | Critical, High Risk, Tier 1 |
| 中リスク | Key, Moderate Risk, Tier 2 |
| 低リスク | Non-key, Low Risk, Tier 3 |
FDAやICH(特にQ8、Q9、Q10)では、開発・バリデーション・市販後の品質保証において、
「リスクベースアプローチ(Risk-Based Approach)」
を推奨しており、リスク(=重要度)の評価と分類は全ての品質・工程要素に対して実施するべきものです。
| 工程 | IPQAの例 | 関連するCQAとの関係(例) |
|---|---|---|
| 培養 (Upstream) | 細胞密度(VCD) 比活性(specific productivity) 溶存酸素(DO) グルコース濃度 pH | 高すぎる細胞密度 → 糖鎖異常や産生物凝集などに影響 |
| 精製(Downstream) | 蛋白質濃度(A280) 導電率(conductivity) pH(バッファー置換) 溶出パターン(クロマトグラフィー) | 過剰な塩濃度やpH変化 → 純度や安定性に影響 |
| 製剤化 | 濃度均一性 pH 浸透圧 ろ過時の流速 | 投与安全性、安定性、無菌性への影響 |
PCは,FDA PV アプローチにおける核心部であり,開発したプロセスの頑健性を評価する試験群である.
各工程には操作パラメータ(process parameter: PP)があり,このPPの組み合わせによりperformance attributeに影響を与える.PPの値とperformance attributeとの因果関係とバランスについて確認される.
確認する方法は,small-scaleおよびpilot-scaleでのPC試験が用いられる.その試験法としてOFATまたはdesign of experiments(DoE)がある.試験結果から重要度を評価する.これらの結果は「commercial-scale」の製造条件として評価するのであるから,そのsmall-scaleやpilot-scaleは適格性が検証されていなければならない.PC試験の結果が不良である場合,プロセスの再設計も検討する必要性もあり得る.
| 項目 | PP/PA | 分類 | 評価理由 |
|---|---|---|---|
| 培養温度 | PP | CPP | タンパクの構造・糖鎖修飾に影響(CQAと強く関連) |
| 発現量(生産量) | PA | CPA or Key PA | 歩留まりや供給の安定性に関連(CQAとは間接的) |
| 溶存酸素(DO) | PP | Key PP | 一定の範囲内で制御されていれば問題ない場合も |
| 培地pH | PP | CPP | 酵素活性、タンパク質安定性に直結(CQAに影響) |
このステージでは,管理戦略の設計も含まれる.
前ステージまでにperformance attribute (PP)が設計されている.この基準がcommercial-scale製造において適合しているかを「process performance qualification (PPQ)」という製造バッチで検証する.不備が確認されれば,プロセスの再設計も検討する.
とは,管理戦略に従い市販後の製品についてPPQで検証された状態が維持されていることを継続的に確認することである.更に,このステージにより製造プロセスの理解を深化させ知識管理体験を充実させることができる.
ICHや各国規制当局は,医薬品開発の基本的な考え方としてQbDがまとめられている.
定義(FDAガイダンス 2011年)
“Process validation is the collection and evaluation of data, from the process design stage through commercial production, which establishes scientific evidence that a process is capable of consistently delivering quality product.”
つまり:
3つのステージから構成されるライフサイクルアプローチ
Stage 1: Process Design(プロセス設計)
✅ 「このプロセスで本当に安定して作れるの?」を科学的に説明する段階
Stage 2: Process Qualification(プロセス適格性評価)
✅ 「この設備と人・条件で、ちゃんと作れるのか?」を検証する段階
Stage 3: Continued Process Verification(継続的プロセス検証)
✅ 「ずっと安定して作れているか?」を監視・改善していく段階
特徴とFDAの期待する点
| 特徴 | 内容 |
|---|---|
| 科学的根拠(Science-based) | DoEやリスク評価を通じて設計されたプロセス |
| ライフサイクル思考 | 一度きりで終わらず、変更・改善も含む |
| データ駆動 | モニタリングや統計的分析により判断 |
| 統合的品質保証 | QbD、PQS(ICH Q10)、QRM(ICH Q9)と整合 |
FDA査察でのチェックポイント(例)
まとめ:FDA PVアプローチの本質
| ポイント | 内容 |
|---|---|
| ✅ 単なる「一発勝負」ではない | 開発段階から市販後までの連続した活動 |
| ✅ 科学的に設計・管理されているか | データと根拠に基づく設計・制御 |
| ✅ 継続的改善が前提 | CPVを通じてプロセス理解と改善を継続する姿勢 |
「Biological Products QbD Pilot Program(2008)」は、FDAがQuality by Design(QbD)をバイオ医薬品に適用する試験的枠組みとして立ち上げた非常に重要な取り組みです。
このプログラムは、のちのQbDのCMC適用、CTD記載方法、FDAとの事前対話に強く影響を与えました。
概要:Biological Products QbD Pilot Program(2008)
| 項目 | 内容 |
|---|---|
| 名称 | Biological Products Quality by Design Pilot Program |
| 実施主体 | FDA / CBER(Center for Biologics Evaluation and Research) |
| 開始年 | 2008年(正式発表) |
| 目的 | バイオ医薬品分野にQbDを導入・促進し、科学的根拠に基づいた申請・審査のモデルを構築すること |
主な目的と背景
| 目的 | 説明 |
|---|---|
| QbDの理解促進 | バイオ製品におけるQbD適用例を収集・分析 |
| FDA-企業の協働強化 | 審査官との「科学的対話」を促進する(例:CQAや設計空間の説明) |
| 新しいCTD記載の提案 | QbDに基づくCMC情報の書き方を模索(例:3.2.S / 3.2.P構成) |
| 実証的プロジェクト | 応募企業が実際の申請資料を使ってFDAにQbD事例を提示・議論 |
プログラムの特徴
参加企業・製品(例)
当時の公表情報や関連会議資料から、以下の企業が参加したとされています(正式な全社リストは非公開)。
| 企業(例) | 製品(推定) |
|---|---|
| Genentech | モノクローナル抗体製品 |
| Amgen | エリスロポエチン製剤など |
| Centocor(現Janssen) | 抗体製剤 |
| MedImmune(現AstraZeneca) | 抗ウイルス抗体など |
FDAの得た知見(公表されている内容より)
プログラムの成果・影響
| 分野 | 成果 |
|---|---|
| CTDの記載法の改善 | モジュール3(3.2.S / 3.2.P)へのQbD要素の統合が明確化 |
| FDAの審査指針の更新 | のちの**“QbD Elements in CMC”** ドラフトガイダンス(例:BLA審査項目)へ反映 |
| 査察・承認基準への影響 | リスクベースの査察・継続的プロセス評価(CPV)の重要性が強調されるように |
| ICH活動へのフィードバック | ICH Q8(R2), Q9, Q10 実装における米国側の視点形成に影響 |
まとめ
| 項目 | 内容 |
|---|---|
| プログラム名 | Biological Products QbD Pilot Program |
| 実施年 | 2008年〜 |
| 対象 | バイオ医薬品(主に抗体、タンパク製剤) |
| 目的 | QbD実装事例をFDAと共有し、審査・申請のガイドライン改善 |
| 現在への影響 | BLA申請のQbD化、Design Space活用、Control Strategy明示などに広く影響 |
QbD(Quality by Design)ベースでBLA(Biologics License Application)を行う場合のCTD(Common Technical Document)構成テンプレートをご紹介します。
これは、FDA(特にCBER)との協議や、QbD Pilot Program(2008)などから得られた知見をもとに、QTPP → CQA → CPP → Control StrategyといったQbDの流れが明確に反映される形になっています。
QbDベースのBLA提出:CTDモジュール3の構成(テンプレート形式)
| セクション | 内容 | QbD的要素 |
|---|---|---|
| 3.2.S.1 | General Information | 製品概要、命名、構造など |
| 3.2.S.2 | Manufacture | 製造フロー、工程説明、施設情報 |
| 3.2.S.2.3 | Control of Materials | 細胞株、培地、原材料の管理 |
| 3.2.S.2.4 | Control of Critical Steps and Intermediates | CPPとその管理方法(QbDのコア) |
| 3.2.S.3 | Characterization | 分析、同一性、インパク分析 |
| 3.2.S.4 | Control of Drug Substance | CQAに基づく試験項目と規格 |
| 3.2.S.5 | Reference Standards or Materials | 規格物質の設定根拠 |
| 3.2.S.6 | Container Closure System | 包装とその影響(密封性など) |
| 3.2.S.7 | Stability | 長期・加速安定性、設計に基づく条件設定 |
モジュール 3.2.P(製剤:Drug Product)
| セクション | 内容 | QbD的要素 |
|---|---|---|
| 3.2.P.1 | Description and Composition | QTPPを意識した構成設計 |
| 3.2.P.2 | Pharmaceutical Development | QbD要素の中核:CQA、DoE、設計空間、リスク評価の内容をここに記載 |
| 3.2.P.3 | Manufacture | 商業製造プロセス、バッチサイズ、工程管理 |
| 3.2.P.3.3 | Description of Manufacturing Process and Process Controls | CPPとIPQA、PPAの管理戦略 |
| 3.2.P.5 | Control of Drug Product | CQAに基づく規格設定 |
| 3.2.P.7 | Container Closure System | 容器材質・溶出物・適合性 |
| 3.2.P.8 | Stability | QbD設計に基づく条件・期間設定、パラメトリックリリースとの関連もあり得る |
特にQbD要素を強調すべきセクション
| セクション | 内容 |
|---|---|
| 3.2.P.2 | 製剤開発セクションで、QTPP → CQA → CPP/CPA → Control Strategy → Design Spaceの流れを明確に記述 |
| 3.2.S/P.3.3 & 3.2.S/P.2.4 | CPP、Critical Step、IPQA、設計空間(設定した場合)の根拠 |
| Regional information(3.2.R) | FDAとのやり取りで生まれた対話記録や、補足資料を記載することも可能(オプション) |
実際のBLAで使われたQbD構成例(要素)
補足:QbD実装におけるCTD記載のコツ
| ポイント | 説明 |
|---|---|
| ① 流れを論理的に書く | QTPP→CQA→CPP/CPA→Control Strategyの因果関係がつながるように記載 |
| ② 根拠を明示する | DoE、リスク評価、過去の知見などを裏付けにする |
| ③ モデルは図表で見せる | フローチャート、マッピング図、相関グラフがあると審査がスムーズ |
| ④ 必要に応じて補足(3.2.R) | 内容が複雑な場合は、追加資料や説明書をここに置くことで本体を簡潔に保てる |
まとめ:QbDベースBLA提出の基本構成
| モジュール | セクション | QbD要素の主な反映先 |
|---|---|---|
| M3.2.S | S.2.4 / S.3 / S.4 | CPP、Characterization、管理戦略 |
| M3.2.P | P.2 / P.3.3 / P.5 | QTPP、CQA、DoE、設計空間、制御戦略 |
| M3.2.R | 任意(補足) | リスク評価表、モデル、対話内容など |
: A-Mab (case study, 2009)
バイオ医薬品におけるQuality by Design の実践 – 協和発酵キリン(株) 生産本部バイオ生産記述研究所 - Vol.35 No.5 2017 ファルマシア, 最前線 –
1st ObD Approval for Biologics: Gazyva Design Space
1) PhRMA, CHART PACK-Biopharmaceuticals in Perspective (2016).
2) 長部喜幸,治部眞里,情報管理,56, 611-621(2013).
3) 西島正弘,川崎ナナ,“バイオ医薬品 開発の基礎から次世代医薬品まで”,化学同人,京都,2013, pp. 2-3.
4) 河合浩史,化学装置,56, 17-23(2014).
5) Joseph A. D. et al., J. Health Econom., 47, 20-33(2016).
6) Abboud L., Scott H., The Wall Street Journal, 2003 年 9 月 3 日 .
7) CMC Biotech Working Group, “A-Mab:a Case Study in Bioprocess Development”, 2009.
8) Ettore O. et al., Biologicals, 44, 332-340(2016).
9) ICH Harmonised Tripartite Guideline, “Pharmaceutical Development Q8(R2)”,2009.
10) ICH Harmonised Tripartite Guideline, “Development and Manufacture of Drug Substances (Chemical Entities and Biotechnological/Biological Entities) Q11”,2012.
11) FDA Office of Pharmaceutical Quality, “MAPP 5016.1-Applying ICH Q8(R2), Q9, and Q10 Principles to Chemistry, Manufacturing, and Controls Review”, 2016.
12) ICH Harmonised Tripartite Guideline, “Specifications: Test Procedures and Acceptance Criteria for Biotechnological/Biological Products Q6B”,1999.
13) FDA Guidance for industry, “Process Validation General Principle and Practice”, 2011.
14) ICH Harmonised Tripartite Guideline, “Pharmaceutical Quality System Q10”, 2008.
15) Feroz J. et al., “Quality by Design for Biopharmaceutical Drug Product Development”, Springer, 2016, pp. 17.
16) Hirofumi K. et al., J. Pharm. Innov., 7,195-204(2012).
2024/01/25 Mr.HARIKIRI
2025/04/09 内容を大幅に追記
![[Bio] 1st QbD Approval for Biologics](https://harikiri.diskstation.me/myblog/wp-content/uploads/2021/02/02EFCDFA-2F1F-4542-819B-78B1FA05C140.jpeg)
にバイオ医薬品として初めてQbDを用いて求めたDesin SpaceによるBLA承認を取得した.
バイオ医薬品の品質に関するデザインスペースの概念と実践について、ジェネンテック社の経験を紹介したものです。デザインスペースとは、製品の品質属性を満たすためにプロセスパラメータ(PP)を変化させることができる範囲のことです。デザインスペース(DS)が承認されると、製造者は柔軟にプロセスを最適化(optimize)できます。しかし、DSの承認には、多くのデータや根拠が必要です。
文書では、ジェネンテック社が二つの製品(PerjetaとGazyva)について、全面的なQbD(品質に関するデザイン)の申請を行った結果を報告しています。
Perjetaはデザインスペースの承認を得られませんでしたが、Gazyvaはデザインスペースの承認を得ることができました。文書では、デザインスペースの承認を得るために、以下のようなポイントが重要であると述べています。
文書は、バイオ医薬品の品質管理におけるデザインスペースの意義と課題について、実例を交えて解説しています。詳しくはこちらをご覧ください
1st ObD Approval for Biologics: Gazyva Design Space (2013)
https://qbdworks.com/qbd-biologics-gazyva-design-space/
2024/01/25 Mr.HARIKIRI
![[WP] 2024年,WordPressサイトにメンバーシッププラグインを選らぶ](https://harikiri.diskstation.me/myblog/wp-content/uploads/2019/12/DFCE24D5-7AEA-4FF0-820C-D054B48E2D5C.jpeg)
自分のblogのWordPressサイトでmember shipプラグインを導入してメンバーシップサイトを作れないか実験的に検討をしていた時期がありました.AMP対応のためのプラグインとのコンフリクトを解消できずに止めてしまっていました.
最近,AMP対応をやっと断念することに至ったのでもう一度チャレンジしようと思っています.
会員制ということです.サイトにあるユーザーが登録すると,例えば会員レベルに応じて未登録では見れなかったページや<more>のブロック部分を閲覧できたり,定期購読のメールが飛んできたりできます.
今回,再度チャレンジしたいと思い,どのmember shipプラグインが良いかを調べることにしましたが,kinstaに良い記事があったので,リンクを張っておきます.
やはり,Ultimate Membership (UM)が良いようです.以前も最初に検討したのが,このUMでした.
当時は,AMP対応を模索していたので,コンフリクトがあったため,UMを含むそのたのmember shipプラグインの検討・導入を終了させていました.
今回は,もう一度UMを導入してみようと思います.有料版も29ドルとこれらのプラグインの名では,お手頃との評価です.
経常収益獲得のためのWordPress用会員制サイトプラグイン24選 (2023/08)
https://kinsta.com/jp/blog/wordpress-membership-plugins/#1-ultimate-membership-pro–29
2024/01/25 Mr.Harikiri
![[Kw] Roche社の製造ストラテジー](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/09/0E1A8FDA-ABDA-4D42-811D-BE0041CBB6CB.jpeg)
の開発が完了して製造承認を取得できれば市場に投入(Lounch)されます.その後は市場の需要が高まるにつれて製造量が増加します.当初の製造は内製で行われますが,需要の定常状態に移行するタイミングで外部での製造も進めて内製と外製の両体制に移行していきます.内製での効率的な製造が低下してくれば外製の割合を増やしてゆきます.一般的には,内製の割合はゼロとなり外製のみで製品寿命が尽きるまで製造されます.
これがRoche社の製造戦略です.
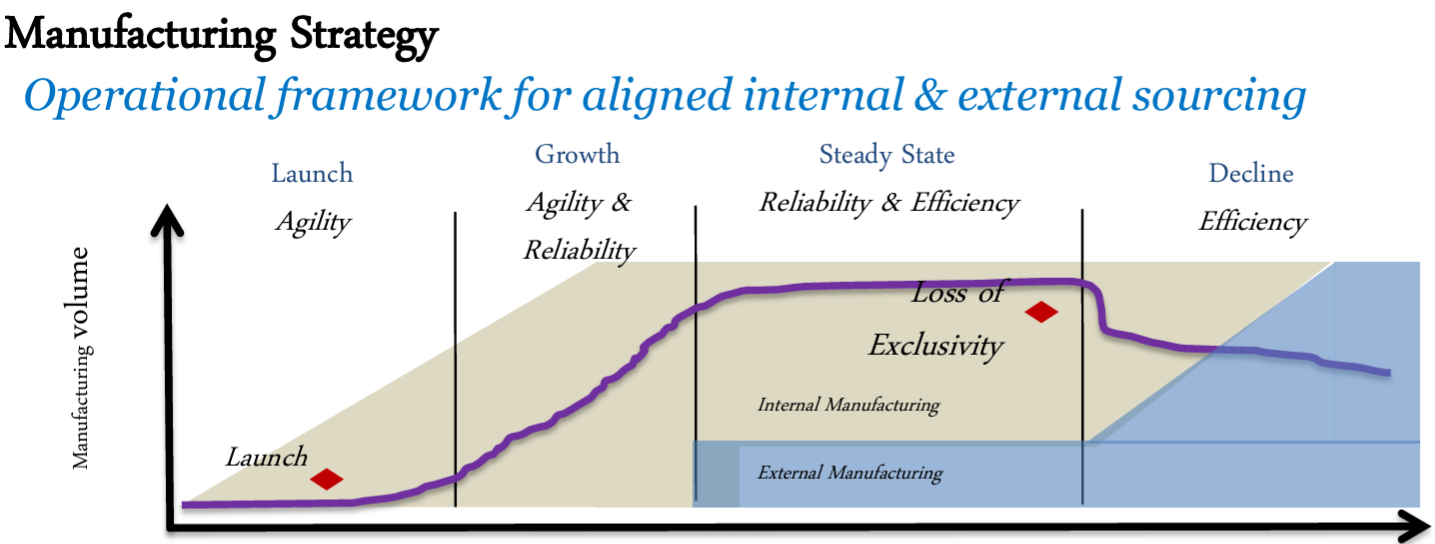
Ensuring the Supply of Quality Biopharmaceuticals: Integrated Manufacturing Network & Continual Improvement of Manufacturing Process (Roche)
chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/https://pqri.org/wp-content/uploads/2015/11/Moore.pdf
![[WP] あるページのある位置に他のページを遅延表示させるには[ただいま情報収集中]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2021/02/80F3D755-3019-49C6-BDAE-47D137C87826.jpeg)
のレスポンスをなるべく落とさずWordPressの機能を強化するにはどうしたらというお話です.
例えば,ページが表示される際に他のページを挿入したい時,単純に挿入すると表示速度は追加されたページの大きさだけ遅くなってしまいます.
画像の遅延表示についてはプラグインもあったり,最近のWordPress 5.5からはHTML5として実装されているとも聞きます.対応しているブラウザでは遅延表示が可能となっているようです.
のphpコードの書き方について以下調査しました.調査した範囲ではimageの遅延表示についてがほとんどでした.今回はここまで.
2024/01/23 Mr.Harikiri
Is any way to call lazyblock from PHP code?
ここに記載の機能は,単純にページの挿入するためのコードのように思う by Mr.H
https://wordpress.org/support/topic/is-any-way-to-call-lazyblock-from-php-code/
WordPress Lazy Loading using Pagination
記載のコードは,ページネーションの表示ブロックを遅延表示させるようだ by Mr.H
https://stackoverflow.com/questions/56637182/wordpress-lazy-loading-using-pagination
Build Your Own Simple Lazy Loading Functionality in WordPress
javascriptであるLozadというライブライを使ってimageを遅延表示
https://macarthur.me/posts/build-your-own-simple-lazy-loading-functionality-in-wordpress
How to Lazy Load in WordPress (Images & Videos) – JetPack –
Jetpackプラグインの使用や,プラグインを使用しないでfunctions.phpにコードを書く方法など詳細な説明あり by Mr.H
https://jetpack.com/blog/wordpress-lazy-loading/
![[Kw] カタルシス](https://harikiri.diskstation.me/myblog/wp-content/uploads/2021/02/80F3D755-3019-49C6-BDAE-47D137C87826.jpeg)
とは,観察者が安全な位置から悲劇を見ることで,同種の日ごろ鬱積した情緒が解放され浄化されること.例えば,悲劇の舞台や映画,物語を聞いたりすることで鬱積した情緒が解放される.
2024/01/23 Mr.HARIKIRI