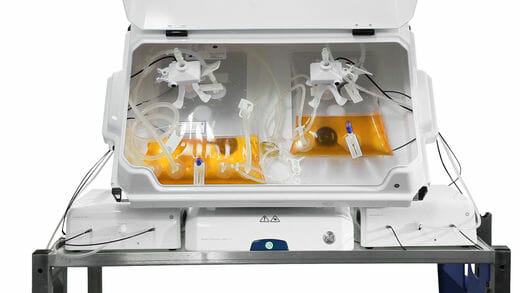
WAVE 25 Rocker
ロッキング型のバイオリアクター。25Lまで培養可能。
ReadyToProcess WAVE 25 Rocker – GE Healthcare
https://www.gelifesciences.com/en/sg/shop/cell-culture-and-fermentation/rocking-bioreactors/systems/readytoprocess-wave-25-rocker-p-05542

wave 25 rocker
![[Bio-Equip] WAVE 25 Rocker – GE – ID11509 [2020/03/06]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/03/F04184F5-A147-4354-B2F0-F5A425F8E86D.jpeg)
ロッキング型のバイオリアクター。25Lまで培養可能。
ReadyToProcess WAVE 25 Rocker – GE Healthcare
https://www.gelifesciences.com/en/sg/shop/cell-culture-and-fermentation/rocking-bioreactors/systems/readytoprocess-wave-25-rocker-p-05542
![[Bio-Equip] Zeta Plus – 培養上の清澄ろ過 – 3M – ID11472 [2020/03/06]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/02/7F03932E-6B98-4068-A403-065E901986F3.jpeg)
細胞と培養上清を分離する工程である
スモールスケールでは、ろ過膜によりハーベストを実施する。5000L以上の培養スケールでは、連続遠心機が使用される
Zeta PlusTM シングルユース吸着デプスフィルター製品 – 3M
https://multimedia.3m.com/mws/media/983784O/cun-p15.pdf

編集履歴 2020/03/06 Mr.HARIKIRI
![[Bio-Equip] Flexsafe RM – Wave Bioreactor シングルユースバッグ – Sartorius – ID11421](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/03/DF8E3C47-632D-4D53-BCE5-AA22C9B21FB9.jpeg)
Wave培養用シングルユースバッグ
Flexsafe® RM
Disposable Cultivation Chambers for Rocking Motion Bioreactors
Flexsafe® RM
https://www.sartorius.com/resource/blob/58506/96438c46c1d8d0cfc897509d0c7941b9/data-flexsafe-rm-sbt2013-e-data.pdf
Disposable Cultivation Chambers for Rocking Motion Bioreactors
Biostat® RM and Flexsafe® RM for Seed Production and Small-scale Protein Supply
http://sartorius-sd.com.ua/files/Bioreactors/onetime_bioreactors/Broch_Biostat-RM.pdf
Allegro™ MVP Single-Use System
https://shop.pall.com/us/en/biotech/single-use-solutions/automated-systems/allegro-mvp-single-use-system-zidhlieud7s
編集履歴 2020/03/06 Mr.HARIKIRI
![[Bio-Equip] Erlenmeyer Flask – 初期培養用フラスコ – ID11424 [2020/03/06]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/03/EE921D3A-7196-41DE-91E3-860C823C8122-e1583504618956.jpeg)
セル・バンクの融解から始める初期の培養に使用
編集履歴 2020/03/06 Mr.HARIKIRI
Erlenmeyer Flask – IWAKI
http://www.iwakiglassindonesia.com/jp/product/erlenmeyer-flask-glass-stopper
![[Bio-Equip] Vi-CELL XR – 性細胞数を測定 – BeckMan Coulter – ID11412 [2020/03/06]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/03/C9AE8E80-DDA2-4227-B1CE-81C9548F6E55.png)
トリパンプルー染色法を用いた培養細胞の生死細胞を自動的に分析してする自動装置です。サンプルをカップに入れるだけで細胞の染色から解析データの印刷までを全自動で行います。
従来の光学顕微鏡と血球計算板を用いる方法を自動化する装置であり、同時に10サンプルの測定が可能です。
BeckMan-Coulter
生死細胞オートアナライザー
https://ls.beckmancoulter.co.jp/products/cell-counting/vi-cell
Vi-CELL XR – BECKMAN COULTER
編集履歴 2020/03/06 Mr.HARIKIRI
![クラウドファンディングの紹介 – 大阪大学発ベンチャー「ビズジーン」- 新型コロナウイルス感染症の “使い切り検査キット” – [2020/03/05]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2021/02/80F3D755-3019-49C6-BDAE-47D137C87826.jpeg)
ID11374
日本の大阪大学発ベンチャー「ビズジーン」がコロナウイルス検査キット開発に対して資金を募ってます。#コロナウイルス #検査キット #ビズジーン
実証試験の第一層試験までの目標資金300万円は、14時間で得られたようです。これらの検査薬の実証試験は、医薬品と同様のスタイルで実行する必要があるため、今後、第二層試験、第三層試験と進める必要があります。
そのような理由から、ファンディングは継続されています。
一部報道にあるように、国立感染症研究所は、ビズジーンに対してコロナウイルス株の提供を拒んでいるとの事ですが、なぜなのでしょうか?
でも、いずれはコロナウイルス株も入手されて、コロナウイルスの検査キットはできあがるものと信じています。
2020/03/05 はりきり(Mr)
タイトル:新型コロナウイルス:使い切りの”簡易検査キット”開発への一歩を
◾ READYFOR株式会社とは https://corp.readyfor.jp/
READYFOR株式会社は、「誰もがやりたいことを実現できる世の中をつくる」をビジョンに日本初・国内最大級のクラウドファンディングサービス「READYFOR」を運営しています。2011年3月のサービス開始から1.3万件以上のプロジェクトを掲載し、58万人から約100億円の資金を集め、国内最大級のクラウドファンディングサービスとして、中学生から80代の方まで幅広い方々の夢への一歩をサポートしています。(2020年2月時点)「カンブリア宮殿」をはじめ様々なメディアに掲載され、2016年6月サービス産業生産性協議会が主催する第1回日本サービス大賞優秀賞を受賞。
下記、参考記事よりREADYFORについて抜粋。
| 項目 | ビズジーン | PCR |
| 測定時間 | 15分 | 6時間 |
| 同時測定 | 1検体/キット | 1~96検体 |
| 原理 | 核酸クロマト (相補遺伝子配列 による補足) | 核酸増幅 (1つあれば増幅可能) |
| 検出感度 | 低い | 高い |
| 検査の適用時期 | 感染初期を除く確定判定 | 極初期からの確定判定 |
新型コロナウイルス感染症:使い切りの “簡易検査キット” 開発へ、クラウドファンディングサービス「READYFOR」にて支援募集を開始。 - JIJI.COM より
https://readyfor.jp/projects/visgene01
【阪大ベンチャー】ビズジーン新型コロナウイルス肺炎「15分簡易検査キット」開発したが、感染研がウイルス株提供せず - かんKANSAI SANPO BLOG より
https://kansai-sanpo.com/visgene02/
新型コロナウイルス:使い切りの”簡易検査キット”開発への一歩を - READYFOR より
第一目標達成のお礼 (3/1追記)
https://readyfor.jp/projects/visgene01
![[Bio-Equip] Pod Filter System – 培養液清澄ろ過 – Millipore – ID118625 [2020/03/03]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/02/4664DC88-21DA-4F70-9AA5-89B18A47C79E.jpeg)
Harvestに使用されるMillipreのろ過システム

Millipore, pod filter system
https://www.merckmillipore.com/Web-JP-Site/ja_JP/-/JPY/ShowDocument-Pronet?id=201306.13804
編集履歴 2020/03/03 Mr.HARIKIRI
![[健康] 風邪ウイルス (まとめ) – イラノウイルス、アデノウイルス、コロナウイルス・・・ – かぜは万病の元 – ID11306 [2020/03/03]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2021/02/80F3D755-3019-49C6-BDAE-47D137C87826.jpeg)
A型インフルエンザとライノウイルスの同時感染は、高い確率で起こらないことが、大規模研究の報告がなされています 7)
1) ライノウイルスについて – 横浜市
https://www.msdmanuals.com/ja-jp/ホーム/news/external/2019/12/17/18/43/753101
2) アデノウイルス解説ページ-アデノウイルスの種類と病気
https://www.niid.go.jp/niid/ja/adeno-pfc-m/2110-idsc/4th/4326-adeno-virus-page2.html
3) コロナウイルス(投稿)
4) RSウイルス (RSV) 感染症とヒトメタニューモウイルス感染症- MSDマニュアル 家庭版
https://www.msdmanuals.com/ja-jp/ホーム/23-小児の健康上の問題/乳児と小児におけるウイルス感染症/rsウイルス-(rsv)-感染症とヒトメタニューモウイルス感染症
5) かぜ(感冒)- MSDマニュアル 家庭版
https://www.msdmanuals.com/ja-jp/ホーム/16-感染症/ウイルス感染症/かぜ(感冒)?query=ライノウイルス
6) 扁桃・咽頭炎- MSDマニュアル 家庭版
https://www.msdmanuals.com/ja-jp/ホーム/19-耳、鼻、のどの病気/口とのどの病気/扁桃・咽頭炎?query=ライノウイルス
7) 風邪とインフルエンザの同時感染がめったにない理由- MSDマニュアル 家庭版
https://www.msdmanuals.com/ja-jp/ホーム/news/external/2019/12/17/18/43/753101
![気になる企業 – AVIGEN – Genezymeに買収 – △ID11266 [2020/03/03]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2019/10/B4F24978-42E9-477E-92B0-94605AEBEAB4.jpeg)
「気になる企業」シリーズ。バイオ医薬品に関わる企業の情報を取りまとめています。遺伝子治療薬の開発ベンチーであった「Avigen」社は、Genezymeに買収されており、現在は、存在していない。
Genzymeは、Sanofiと合併している
Sanofi Genezyme
https://www.sanofi.co.jp/ja/about-us/product/genzyme
Avigen, Inc.’s Gene Therapy Technology Acquired By Genzyme Corporation
https://www.biospace.com/article/releases/avigen-inc-s-gene-therapy-technology-acquired-by-genzyme-corporation-/
編集履歴 2020/03/03 Mr.HARIKIRI