はじめに
医薬品・再生医療等製品の開発において、PMDA相談を「どの段階で」「どこまで」使うかは、開発の成否や申請スケジュールを左右します。
特に、RS相談と治験相談の違いが曖昧なまま進めてしまうケースや、
申請前相談の位置づけを誤り、申請直前で手戻りが発生するケースは少なくありません。
さらに、相談費用や**振込期限(いつまでに支払うのか)**は社内調整上の盲点になりやすく、実務トラブルの原因にもなりがちです。
本記事では、PMDAの相談制度について、制度の全体像から、申請前相談の正しい理解、費用・振込期限の実務ポイントまでを開発実務者の視点でアウララインを整理しました。
この記事でわかること(要約)
- PMDA相談制度の全体構造(事前面談/RS相談/治験相談/申請前相談)
- RS相談と治験相談の違い、使い分けの考え方
- 見落とされがちな**「申請前相談」の正式な位置づけと役割**
- 相談区分ごとの費用の目安と考え方
- 相談費用の振込期限はいつ決まるのか、遅れた場合の扱い
- 開発フェーズ別に「どの相談を使うべきか」の判断ポイント
※本記事はPMDA公式公開情報(一次情報)に基づいて整理していますが、個別案件の判断には薬事・レギュラトリー専門家への確認が必要です。
【PMDA相談制度一覧(費用付き・実務最終版)】
◆ 医薬品・再生医療等製品(PMDA本体)
| フェーズ | 相談区分 | 主目的(実務要約) | 主な相談内容 | 費用目安(税別) |
|---|---|---|---|---|
| 事前整理 | 事前面談 | 相談設計 | 相談区分選定、論点整理 | 無料 |
| 開発初期 | RS相談 | 開発思想の妥当性確認 | 開発戦略、新規技術評価、評価概念 | 約100~200万円 |
| 治験準備 | 初回治験相談 | FIH成立性 | 初回投与量、安全性評価設計 | 約150~200万円 |
| 治験全般 | 治験相談(一般) | 試験設計妥当性 | 非臨床・臨床試験計画 | 約100~150万円 |
| 治験中 | 反復治験相談 | 設計変更対応 | 用量変更、評価項目追加 | 約80~120万円 |
| 治験形態 | 医師主導治験相談 | 治験枠組み整理 | 医師主導治験の設計・運用 | 約50~100万円 |
| 分野別 | 品質相談(CMC) | CMC成立性 | 原薬・製剤設計、規格、管理戦略 | 約100~150万円 |
| 分野別 | 安全性相談 | 安全性論理整理 | 毒性評価、非臨床→臨床外挿 | 約100~150万円 |
| 分野別 | 有効性相談 | 有効性論理整理 | エンドポイント、評価指標 | 約100~150万円 |
| 申請直前 | 承認申請前相談 | 申請成立性の最終確認 | CTD構成、全データ整合性 | 約150~250万円 |
| 承認後 | 承認後相談 | LCM管理 | 変更管理、追加試験 | 約50~100万円 |
| 制度連動 | 先駆け総合評価相談 | 早期承認戦略 | 先駆け指定制度対応 | 約200~300万円 |
| 制度連動 | 条件付き早期承認相談 | 不確実性管理 | 代替評価指標、条件整理 | 約200~300万円 |
| モダリティ | 再生医療等製品相談 | 特殊論点整理 | 細胞・遺伝子特有課題 | 約150~300万円 |
◆ 医療機器・体外診断用医薬品(参考:別体系)
| 区分 | 相談区分 | 主目的 | 費用目安 |
|---|---|---|---|
| 医療機器 | 医療機器相談 | 開発・承認戦略 | 約50~150万円 |
| IVD | 体外診断用医薬品相談 | 性能・臨床性能 | 約50~150万円 |
【注意点】
- 金額は年度・案件内容で変動
- 正式金額・名称は必ず最新のPMDA公表資料を確認
- 個別案件の相談戦略は専門家に確認が必要
【出典】
- PMDA
- 「対面助言・相談制度の概要」
- 「承認申請前に実施する対面助言の取扱い」
- 「手数料に関する告示・Q&A」
(PMDA公式Webサイト/一次情報)
第1章:PMDA相談制度の全体像
PMDAの相談制度は、**「承認審査の代替」ではなく、「承認に至るまでの開発判断を段階的に支援する仕組み」**として設計されています。
最大の特徴は、医薬品開発のフェーズごとに相談の役割が明確に分かれている点です。
PMDA相談制度は「開発フェーズ対応型」
PMDA相談は、単一の万能相談ではなく、開発の進行に合わせて“相談の性格が変化する”構造になっています。
- 開発初期:
→ 「この開発戦略・考え方は科学的に妥当か」 - 治験段階:
→ 「この試験設計で有効性・安全性を評価できるか」 - 申請直前:
→ 「このデータ構成・論理で申請に進めるか」
このため、RS相談・治験相談・申請前相談は互いに代替できません。
PMDA相談の全体フロー(概念図)
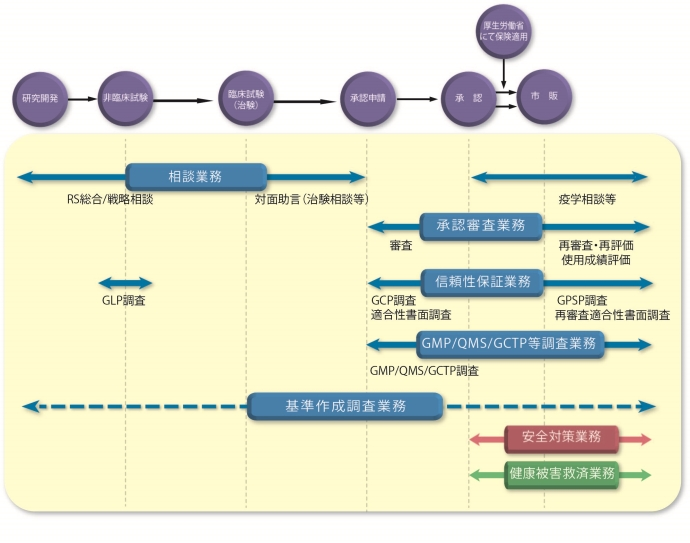
~メンバー専用 ↓
~~~~~~~~~~~~~~~~~~~
↑ メンバー専用~
無料登録は右の握手ボタンからかできます. ~~~~~~~~~~~~~~~~~~~
まとめ
PMDAの相談制度は、医薬品・再生医療等製品の開発を段階的に支援するために設計された仕組みである。RS相談は開発初期における評価概念や戦略の妥当性を確認する場であり、治験相談は具体的な試験設計を固めるための相談、申請前相談は承認申請直前にCTD全体の整合性を確認する最終チェックに位置づけられる。各相談は代替関係ではなく積み上げ型で活用すべきであり、費用は原則事前納付、振込期限はPMDAからの実施決定通知により個別に指定される。制度の正しい理解と計画的な利用が、開発の手戻り防止と承認成功率の向上につながる。
2026/01/24, はりきり (with ChatGPT),いずれにせよPMPD相談は出来る限り活用すべきだということがわかった.

コメントを残す