Post Views: 566
dashicons.mini.cssについて
WordPressのメニューに使用するアイコンのcssファイル (dashicons.min.css)は、headerに位置されていますが、Google PageSpeed Insightsのテストでは、スコアを重くする原因の一つです。
このスコアの改善をしたくてググっていると、スコア改善のために、dashicons.min.cssをfooterに移動させたと考えているユーザーがいました。
以下のリンクページで、そのコードがアップされていたので、function.phpにコピペして試してみました。その結果、footerへの移動もできていないようで、数値も殆ど変わりませんでした。
作業記録としてここに、コードを残します。
コード
今後、このあたりの検討をする場合に、参考にしたいためです。
Final working solution was:
add_action( 'wp_print_styles', 'my_deregister_styles' );
function my_deregister_styles() {
wp_deregister_style( 'dashicons' );
}
add_action( 'wp_footer', 'register_wp_footer' );
function register_wp_footer() {
wp_enqueue_style( 'dashicons', '/wp-includes/css/dashicons.min.css');
}
jquery.jsについて
因みに、「jquery.js」は、最初に読み込まれていなればいけないようです。
わかった事
- dashicons.min.css: footerに移動してもよい
- jquery.js: footerに移動してはいけない
備忘記録 2020/02/14 はりきり(Mr)
Move dashicons.min.css to Footer
https://wordpress.stackexchange.com/questions/341675/move-dashicons-min-css-to-footer
編集履歴
2020/03/15, MR.HARIKIRI
2021/10/22, 文言整備


















![[Town] ytv (読売テレビ新社屋)に行ってきた – ID9584](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/02/853BB3AA-18B3-4388-8FA3-DF297B73C016.jpeg)


















![[Bio-Lab] MasterFlex Pump – ID9538 [2020/02/16]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/02/1125658B-098D-43F6-BCA2-463F62511E02.png)
![[Bio-Lab] HORIBA pH Meter – ID9527 [2020/02/16]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/02/924ED148-79BB-4B83-91EC-F744B62354A9.png)
![[Bio-Lab] Pipette – ID9523 [2020/02/16]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/02/C09B6659-759C-4038-B4EE-95D05C8D6AF9.jpeg)
![[Bio-Lab] NanoDrop – タンパク質濃度の測定 – ID9517 [2020/02/16]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/02/8DD6E25A-102B-4866-9DEB-8C6034B5E509.jpeg)
![[Lab-Equip] SDS-PAGE電気泳動システム – ID9509 [2020/02/16]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/02/8F619952-4274-4AEC-A754-49D5FF23ECF9.jpeg)
![[Life] STARBUCKS、でblogをメンテ – ID9471 [2020/02/15]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/02/0F1E6E54-CF4D-41FE-8B13-469781A1DE71.jpeg)



![[WorPress] dashicons.min.css、headerからfooterに移動してページ速度改善を模索する](https://harikiri.diskstation.me/myblog/wp-content/uploads/2021/02/80F3D755-3019-49C6-BDAE-47D137C87826.jpeg)
![[抗体医薬] クリースビータ 〜 くる病、軟骨化症 〜 キリンHD [2020/02/14]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2019/09/1970DF4E-B641-4DE7-909F-4B091C751E81-1200x831.jpeg)
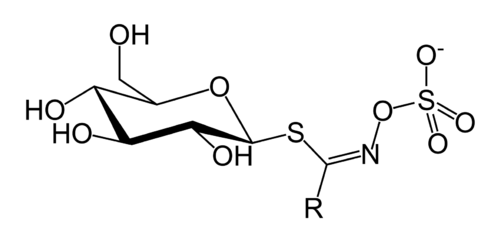
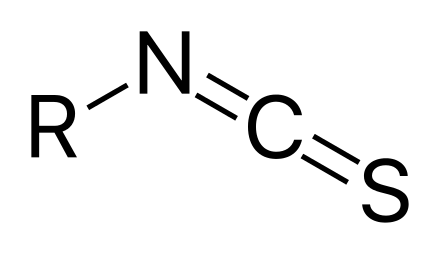
![[Kw] 大根の辛味の正体 – イソチオシアネート](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/09/0E1A8FDA-ABDA-4D42-811D-BE0041CBB6CB.jpeg)