BOEHRINGER INGELHEIM
- 2018年の3つのビジネス(human, animal, biopharma)で約1.7兆円
- 2019年のbiopharmaの売り上げは、約550億円source
- Eli Lillyとのアライアンスを多数行っている source
- First half 2019: High levels of investment in R&D and robust organic growth source
Boehringer Ingelheim BioXcellence™ について、概要としてまとめた。
ベーリンガーインゲルハイムBioXcellence™は、バイオ医薬品受託開発および製造サービスを医薬品およびバイオテクノロジー業界に提供する。 高発現システムを含む細胞株や株の開発からプロセス開発、大規模製造、Fill&Finishまでの幅広いサービスにより、抗体、組換えタンパク質、非抗体の足場、fabフラグメント、哺乳類細胞培養または微生物発酵システムのpDNAの生産が含まれる。

Biosimilarへの関わり
サイトの情報では、Biosimilar製品について記載してが無いこと、ただし、Biosimilarの重要性についての記載があること、からBiosimilarに関わるCDMOサービスの提供でBiosimilarに関わっていると考えられる(はりきり(Mr))。
Cell line
BI-HEX(R) CHOK1、6m for cell line preparation、 scale up capacity from 80 to 15,000L, >300,000L total bioreactor, LIMS (Laboratory Information Management System)
https://www.bioxcellence.com/our-business/mammalian-cell-culture
世界中に4つの製造サイト
- ウィーンの1つの微生物サイトは、施設増設中の哺乳類施設は、商業供給のために2020年から稼働予定
- 上海(中国)は、哺乳類サイト
- 2 x 2,000L SUB
- フリーモント(アメリカ)
- >500 employee
- 哺乳類サイト
- Cell line and process development, clinical & Commercial, Fill Finish.
- 2 x 2,000L, 3 x 15,000L Bioreactor
- ビベラッハ(ドイツ)は、哺乳類サイト。Biberachサイトには、哺乳動物細胞培養から治療用タンパク質と抗体を製造するためのヨーロッパ最大のバイオ医薬品工場があります。 ここでは、6 x 15,000 L Bioreactorを擁する2つの大規模製造工場がある
- H84/H92, 4 x Inoculum suites, 3 x (~2,500L, ~15,000L) Bioreactor, 3 x Purification suites, 3 x Formulation suites
- G104, 4 x Inoculum suites, 3 x (~15,000L) Bioreactor, 1 x Purification suites, 2 x Formulation suites
- 最近の商用培養実績は、290kL
Shanghai Bolinge Yingehan
Boehringer Ingelheim, Fremont, CA
Birkendorfer Str, 65 (ドイツ)
<center.Fill Finish
- 8つの無菌充填スイート(9本の充填ライン)–グローバルネットワーク全体で充填および仕上げ
- バイアルでは0.7 mLから100 mL
- シリンジでは0.4 mLから10 mLの柔軟な充填量
- 溶液、高濃度液体製剤および凍結乾燥(凍結乾燥)粉末
- 100%コントロールとしての目視検査
- 目視検査プロセスには、シリンジとバイアルの手動制御とバイアルのカメラ制御が含まれます
- 材料と機器の電子バッチ記録とバーコード制御アプリケーション
- 3,000-150,000の範囲のロットサイズ
1. バイアル充填
- バイアルは、アクセス制限バリアシステム(RABS)またはアイソレーター内の最新の条件下で充填されます
- 0.7〜100 mLの柔軟なバイアルサイズと充填量
- 1,000から150,000単位の範囲の柔軟なロットサイズ
2. シリンジ充填
- シリンジは、アクセス制限バリアシステム(RABS)またはアイソレーター内の最先端の条件下で充填されます
- 充填量が0.4〜10 mLの1 mL、2.25 mLのガラス製シリンジと10 mLのプラスチック製シリンジが、一次包装の有資格サプライヤーから「Ready To Use」(RTU)を提供
- パイロット規模で9〜12 K、商業規模で25〜150 Kの柔軟なロットサイズ
- 手動の全数目視検査
- すぐに使用できるストッパー
技術移転
大規模商用製造が必要となり、その技術移管は、移管元と移管先であるBOEHRINGER INGELHEIMとで密にコミュニケーションしながら行われる。
バイオ医薬品プロセス移転
グローバルおよび学際的なチームで働く経験豊富なスタッフが、お客様から直接商業プラントへの技術移転を促進します。 ベーリンガーインゲルハイムは、無数の成功した移転の実績により、世界中の患者の利益のためにお客様への供給を確実に確保しています。ホワイトペーパー(2019)を参照。
大規模製造への3ステッププロセス
- F2F @ donor site, BI’s documents, Customer. documents
- F2F, Ship working cell bank and media, small scale (3L) DoE study、Quality checking use the partially purified sample.
- F2F, Results of small scale run (80L, full purification and full testing), preparation of process description, agree/sign

技術移管を成功させる重要な要素
末尾にリストしている参照文献もとに取りまとめた。
顧客から当社の施設への多くの移転において、移転を成功させるために重要な要素が数多く明らかになりました。 移管の初期段階でこれらの側面を考慮し、移管計画でそれらを反映すると、成功の可能性が大幅に高まります。 以下のセクションでは、これらの要素のうち最も重要なものについて詳しく説明します。
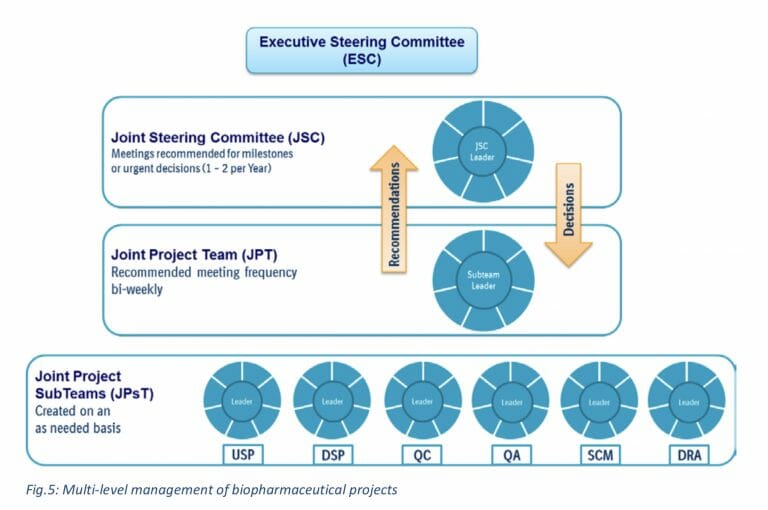
•共同プロジェクトチームとガバナンス構造
• 役割と責任
•事前のドキュメント交換
•ギャップ/リスク分析と軽減
•プロジェクト管理:タイムラインとマイルストーン
• 学んだ教訓
PJ Team
- 上流製造(USP)
- 下流製造(DSP)
- 品質保証(QA)
- 品質管理(QC)
- サプライチェーン管理(SCM)
- 薬事(DRA)
- 共同プロジェクトチームに推奨される会議の頻度は隔週
- 通常、サブチーム会議(内部または顧客とベーリンガーインゲルハイムとの間)は、必要に応じてスケジュールされます
- 合同運営委員会は、定義されたマイルストーンで会合します。通常、年に1〜2回、またはJPTからの要請があれば開催これは通常、主要な機能領域のディレクターレベルで表され、プロジェクト固有の決定を担当します。
- 上級管理職は、通常は副社長レベルまたは上級副社長レベルで代表される執行ステアリング委員会に関与しています。 会議は必要に応じて、または重要なマイルストーンでスケジュールされます。
- ESCのトピックは通常、戦略的決定、またはこの顧客とのプロジェクトポートフォリオ全体に影響を与える決定です。 このセットアップにより、安全で迅速なデータ交換、権限を与えられたチーム、迅速なソリューション、整合した意思決定、および必要に応じた(高レベルの)管理の関与が保証されます。
事前の文書交換
技術移転を成功させるには、キックオフミーティングの前、または少なくとも移転フェーズの最初に、関連するすべてのドキュメントを交換する必要があります。
チームは、個々のワークパッケージを実装するために、ドキュメントを確認して準備する必要があります。
通常、顧客は、ベーリンガーインゲルハイムが評価および交渉フェーズの開始点として提案をまとめることができるように、いくつかの(基本的な)情報を提供しています。 ただし、この情報はあまり詳細ではなく、移転を成功させるためにドナーサイトで現在開発および実装されているため、プロセスを理解するには不十分です。 特にベーリンガーインゲルハイムチームは、詳細な設備適合を実行し、潜在的なギャップを特定して議論し(ギャップ分析の章を参照)、ベーリンガーインゲルハイムのプラントと固有のプロセスをコンパイルするために、その他すべての関連トピックの詳細な理解を得る必要があります。
たとえば、次のドキュメントは通常、顧客から要求されます。
- 製品のMSDS、製品タイプ、1日の投与量、溶解度、毒性
- すべてのパラメーターリストを含む、単位操作あたりの詳細なプロセスの説明(NORとPARの範囲を持つプロセスパラメーター)
- すべての上流および下流ステップの最新の実行済みバッチレコード
- オンラインおよびオフラインのプロセスデータ(ガス処理プロファイル、細胞増殖、クロマトグラム、導電率/ UVなど)
- 収穫からBDSまでのステップ歩留まりとプロセス全体の歩留まり
- 組成と濃度を含む、緩衝液と培地の溶液と容量のリスト
- 特定されたコンポーネント
- 全体的な部品表(BOM)–含む。 ベンダーおよびリリース予定の仕様
- 浸出性/抽出性評価および生物活性物質の除去に関する研究(ウイルスクリアランス検証レポート)
- プロセス検証レポート
- WCB COA、特性評価レポートとBSE / TSEステートメント、細胞株の安定性技術レポート
- お客様のバイオリアクターの機器の形状と操作モード(すべてのバイオリアクターの攪拌機の電力入力、ブレードの種類、ガス処理戦略)
- 分析方法の説明(SOP)、検証プロトコル/レポート
- インプロセス制御、リリース、および安定性の仕様の現在のバージョン
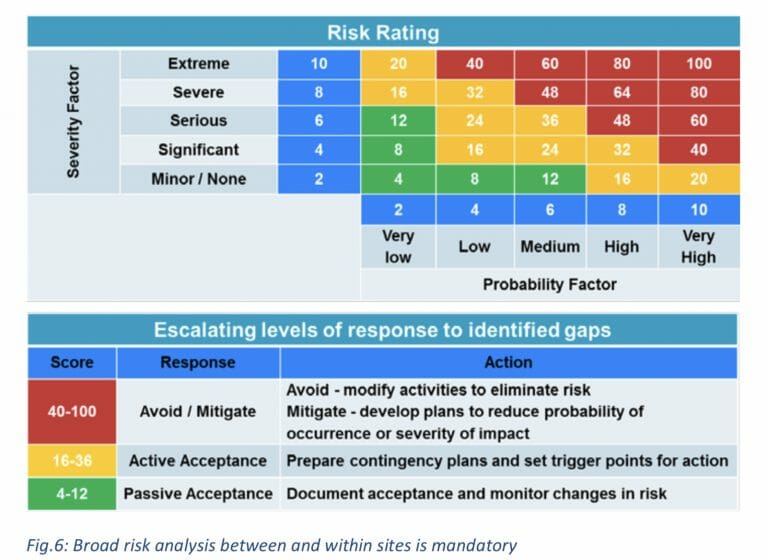
ギャップ/リスク分析と軽減
プロセス移転のもう1つの重要なステップ
- 両方のサイト間のプロセスの違い
- 及び、製造内の手順の違い
- 顧客サイトからの技術レポートは、ドナーサイトで利用可能な機器とシステムを使用して、そこで実装されたプロセスを実施
- これはベーリンガーインゲルハイムのセットアップと完全に同じになることはない
- Boehringer Ingelheimサイトで製造プロセスが確立されると、範囲、設定ポイント、または手順を再評価されます。
- 共同プロジェクトチームは、サイト固有のプロセスの説明と範囲をサポートし、商用バッチを製造するための将来のプロセスを検証するために、これらの変更に対処して同意する必要があります
- 各合同機能チームは、プロセスをまとめて実行し、お客様のサイトでの元のプロセスとは異なる必要な適応または手順を特定する必要があります。
- 個々のトピックは、リスク評価マトリックスに従ってリストおよび評価できます(例は下の図を参照)。
- リスクを下げるためにリスクを軽減する必要はありません。
- トリガーポイントのある緊急時対応計画は、中程度のリスクについて評価されます。
- より高いリスクの場合、リスクを排除するか、リスクの可能性または重大度を低減するために、トピックを変更するアクションが実行されます。
プロジェクト管理:タイムラインとマイルストーン
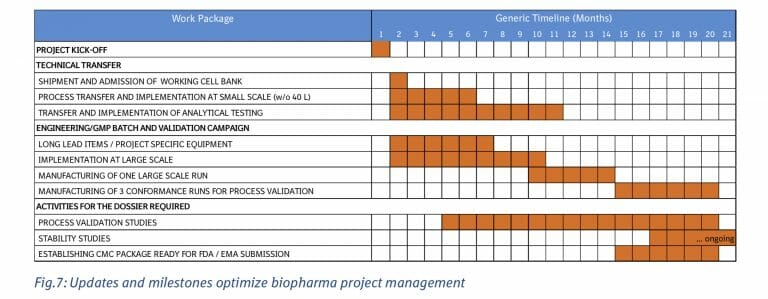
上記の側面に加えて、プロセス移転の初期フェーズについての共通の理解だけでなく、プロジェクトの完全な概要も不可欠です。 高レベルの作業パッケージ内の個々のサブタスクのわずかな遅延は、多くの相互に関連し、時間をずらしたアクティビティにより、全体的なタイムラインに大きな影響を与える可能性があります。 プロジェクトマネージャーは、サブチームリーダーと共に、これらの落とし穴を認識し、タイムラインと変更への対処方法を定期的に更新する必要があります。次のフェーズに入る前に、プロジェクトのチームワークと進捗状況を確認するためのマイルストーンを実装する必要があります。 通常、作業パッケージは時差があり、タイムラインが圧迫されているため、次のフェーズを開始する前に1つのフェーズを完全に完了するのに十分な時間はありません。 ただし、重要なアクティビティが開始される前に(エンジニアリングランや検証ランの解凍など)、運営委員会の関与を伴う対面会議での共同チームレビューをスケジュールする必要があります。
技術移管の期間
技術移管の期間は、20ヶ月、製造のInplementationに5ヶ月, 分析のInplementationに10ヶ月, 1st large runに5ヶ月, 3 batch conformance runに6ヶ月, Process validation studyに15ヶ月
細胞株を渡してからProcess Validation Studyが終わるまでの期間は20ヶ月を要するスケジュールとなる
得られた教訓:生物医薬品プロジェクトの移転
プロジェクトの移管で成功するための鍵は、継続的な改善への取り組みです。 それが、「学んだ教訓」に関するセッションでプロジェクトを完了する動機です。このようなセッションの目的は、繰り返し発生するパターンを特定し、何が効果的で、何がさらに改善される可能性があるかを洞察することです。 両サイドのすべてのチームメンバーは、これらの洞察から大きな利益を得て、それぞれの組織にそれらを取り戻すことができ、各転送が最後よりもスムーズになります。 過去に特定されたいくつかの落とし穴は次のとおりです。
- 分析メソッドの移行が過小評価され、開始が遅すぎます。 また、一種のメソッドの説明(プロセスの説明に匹敵)で要約することを検討する可能性のある多くのドキュメントがあります。 それらを減らすことを試みるべきです。
- プロジェクト管理は、ドキュメントの追跡と監視において積極的な役割を果たす必要があります。 レビューサイクル、承認、翻訳は、バッチレコードだけでなく、CMCドシエドキュメントについても、品質契約の早い段階で定義する必要があります。
- ソースデータのレビューには時間がかかり、リソースを消費します。
- 発生した問題にタイムリーに対処するため、少なくとも最初の実行中に、プラントに人がいることで知識を共有します。
製造技術の移転期間、方法について説明されている
ホワイトペーパー(2019)
Whitepaper: Basis for a fast and successful project transfer

その他情報
コマーシャルに関わったPJ数
最近で20の上市、280,000L Total capacity bioreactor in global network
https://www.bioxcellence.com/our-business/mammalian-cell-culture
We work with 15 of the world’s Top 20 pharma and many innovative biotech companies
https://www.bioxcellence.com/about-us/our-customers
編集履歴
2020/06/02, Mr. Harikiri
2022/11/16, 地図(プラグインからGoolgeMapコードに変更)
