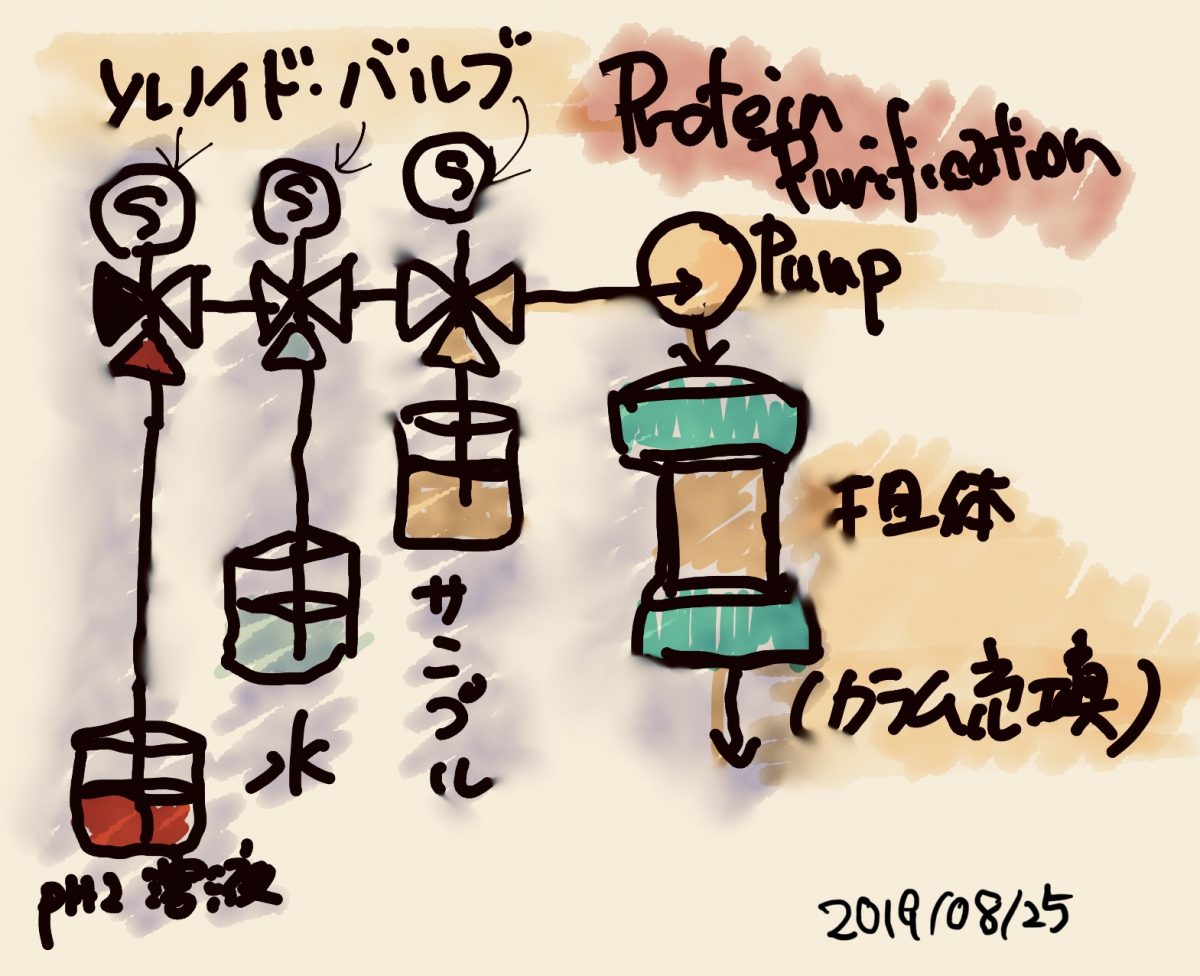
蛋白質精製装置の歴史
もう40年も前から蛋白質の精製装置は開発されている。当時はPharmaciaという社名の企業で市販されていたFPLCという装置が有名だった。
今では、Pharmaciaの社名なくなり、GE Healthcareに変わっていて、精製装置のブランド名は、AKTAになった。
GE Healthcareは、今年中には、GEの業績が不振なことから放出されて、別会社の子会社となるようだ。
引用元 : https://www.gelifesciences.co.jp/newsletter/biodirect_mail/technical_tips/tips60.html
蛋白質の精製方法
一般的に蛋白質は、熱や有機溶剤に弱く、変性してしまうため、有機化合物のようには精製できない。
蛋白質の精製では、水溶液状態を維持しながら精製工程を進めて純度を上げていく必要がある。
そこで、液体をハンドリングする液体クロマトグラフィーであるFPLCやAKTAの出番となる。
精製装置の原理
蛋白質の精製とは、液体をどうコントロールするかということであり、言い換えるとその液体組成のコントロールをいかにするかに尽きる。
主要な溶液組成は、塩濃度を表す電気伝導度 (conductivity)とpHの2つが基本となる。
これらの組み合わせを作り出し、精製の舞台となる担体という場で蛋白質の精製を行う。
担体の選択
担体とは、蛋白質と相互作用がある樹脂と定義できる。
担体は、通常ビーズ状でありその大きさは50~100μmφ、樹脂(Resin)ともいう。
粒子であるため、粒子と粒子の間に水分を濾(こ)すことができる。
具体的には、ガーゼのようなもので樹脂を捕捉し、水分と分離させる。
実際には、樹脂より小さい網目のハードメッシュを円筒の上下につけて樹脂を挟み込んでカラムという筒に充填し、このカラムの片方から液体を流し、もう一方から液体を出すという原理で、担体を使用する。これをクロマトグラフィという。
樹脂(resin)といっても、昔は天然の素材からつくるセルロース系しかなかったが、今日では、合成樹脂(ビニル系など)が使われる。
精製をしようとしている目的蛋白質と不純物質(木吹物質の分解物や重合物、原料上混入してくる産生細胞由来のDNA,細胞成分など)を担体との相互作用によって分別する。
担体は、以下の種類のものを選択する。1種類の担体での精製では不十分であるため、相互作用が異なる単体を選択する。多くても3種類の担体が使用される。
担体の種類
先ず、陰および陽の電荷を持つイオン性のリガンドと呼ばれる低分子化合物を担体に結合させているイオン交換体があげられる。
これらの担体には、親水性の素材が通常使われている。
次に、電荷を持たないが、疎水性の担体がある。これらの担体の性質を併せ持つマルチモーダルな担体もあり、昔らか高度に精製したい場合に、使用されていたハイドロキシアバタイト(リン酸カルシウム塩: HA)は、今でも高度なタンパク精製に使用される。
更に、目的蛋白質と強い特異性で結合できるリガンド分子を担体に結合させたアティニティ担体がある。
アフィニティ担体として、一般的に良く知られているのが、Protein A担体である。血漿分解由来の凝固系蛋白質は、ヘパリンに親和性を持つものがおおく、ヘパリン担体もアフィニティ担体と呼ばれる。
蛋白質精製装置で目的蛋白質を精製する
通常は、蛋白質精製装置(AKTAなど)を使用してカラム・クロマトグラフィーを行う。
また、カラム・クロマトグラフィー工程のつなぎの工程として、UF/DF処理、沈殿化処理、ウイルス除去フィルターろ過なども実施される。
編集履歴
2019/08/25 記載 2020/02/01 改定(個別の工程の説明を分離しそれぞれ個別に説明) 2020/02/18 文言整備、Desktopでは2カラム化(右にフローチャート配置) 2020/10/04 体裁変更